研究院徐彦辉课题组在《MOLECULAR CELL》发表最新研究成果
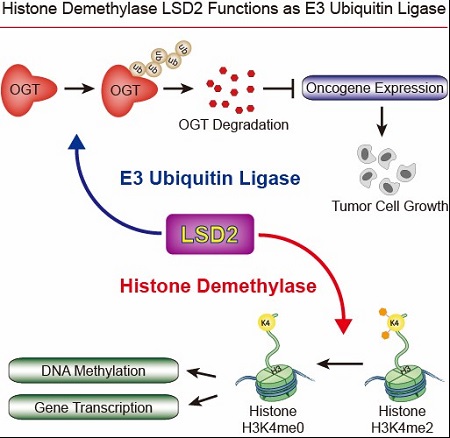
组蛋白甲基化修饰是一种非常重要的表观遗传修饰,参与调节异染色质形成、X染色体失活、基因印记及DNA的损伤修复等多种生命过程。关于组蛋白去甲基化酶的研究是过去十年来生物学领域的研究热点。LSD1是第一个被鉴定的组蛋白去甲基化酶。LSD2是其唯一同源物,能够去除H3K4me1/me2,在胚胎发育过程起重要作用。
3月12日,研究院徐彦辉课题组在《MOLECULAR CELL》杂志在线发表了科研论文:“Histone Demethylase LSD2 Acts as an E3 Ubiquitin Ligase and Inhibits Cancer Cell Growth through Promoting Proteasomal Degradation of OGT”。发现LSD2出人意料地具有E3泛素连接酶活性,其底物为N-乙酰氨基葡萄糖转移酶(OGT),LSD2泛素化OGT并促进其发生蛋白酶体依赖的降解,从而抑制OGT引起的肿瘤细胞生长。LSD2抑制肿瘤细胞生长是依赖于其E3泛素连接酶活性,而不依赖于其组蛋白去甲基化酶活性。LSD2分别通过组蛋白去甲基化酶和E3连接酶活性调控了不同组的靶基因。研究发现了LSD2具备两种独立的酶活性,揭示出了LSD2依赖于其E3连接酶活性的抗肿瘤细胞生长功能,建立了组蛋白去甲基化酶和泛素降解途径的关联。徐彦辉课题组曾于2013年在《Molecular Cell》和《Cell Research》杂志发表LSD2的结构和功能研究阐明其底物识别和酶活性调节机制,这是该课题组对LSD2蛋白功能研究的又一突破性成果。
该项研究得到了国家自然科学基金面上项目(31270779)资助。
作者:徐彦辉课题组