Cell Discovery | 徐彦辉团队揭示SRCAP复合物介导组蛋白H2A.Z置换的分子机制
在真核细胞中,基因组DNA缠绕组蛋白八聚体形成规则排列的核小体。经典核小体包含四种组蛋白H2A、H2B、H3和H4各两个拷贝。为了实现相关功能调节,ATP依赖性染色质重塑复合物会改变核小体的组成和它在DNA上的位置。根据催化亚基的异同,染色质重塑复合物可分为四个家族: ISWI、CHD、SWI/SNF和INO80。
人源SRCAP复合物 (SRCAP-C) 由十个亚基构成,分子量超过一百万道尔顿,属于染色质重塑复合物INO80家族。 SRCAP-C可以ATP依赖性方式用H2A.Z-H2B二聚体取代H2A-H2B二聚体,生成的含有H2A.Z的核小体富集在常染色质中几乎所有基因的启动子处。SRCAP-C参与转录调控和其他基本生理活动,如DNA复制、DNA修复和染色体分离等。
过往的研究揭示了酵母SWR-C (SRCAP-C在酵母中的同源物)和人源SRCAP-C的结构,但SRCAP-C介导的H2A-H2A.Z交换机制仍不完全清楚。
2024年2月8日,我院徐彦辉团队在Cell Discovery杂志上在线发表题为Structure insights into histone exchange by human SRCAP complex的研究论文。该研究利用结构生物学方法,展示了SRCAP-C-核小体复合物的三种功能状态,提出了SRCAP-C水解ATP过程中改变对底物核小体的结合方式进而实现H2A-H2A.Z交换的机制模型,该模型的关键点通过ChIP-seq技术在细胞内得到了功能验证。

研究团队分别获得了SRCAP-C-核小体复合物在apo(无核苷酸结合),ADP,ADP-BeFx(ATP类似物)结合状态下的冷冻电镜结构,整体分辨率为3.3 Å,核心分辨率达到2.9 Å。结构表明,SRCAP-C可分为motor和ARP两个模块,其中由6个亚基组成的ARP模块在之前的结构研究中均未被解析。ARP模块沿着DNA环绕一半核小体,在三种状态中保持类似的构象及核小体结合模式,可能抑制DNA相对核小体的滑移,这是SRCAP-C区别于其他重塑复合物的关键特征(图1)。
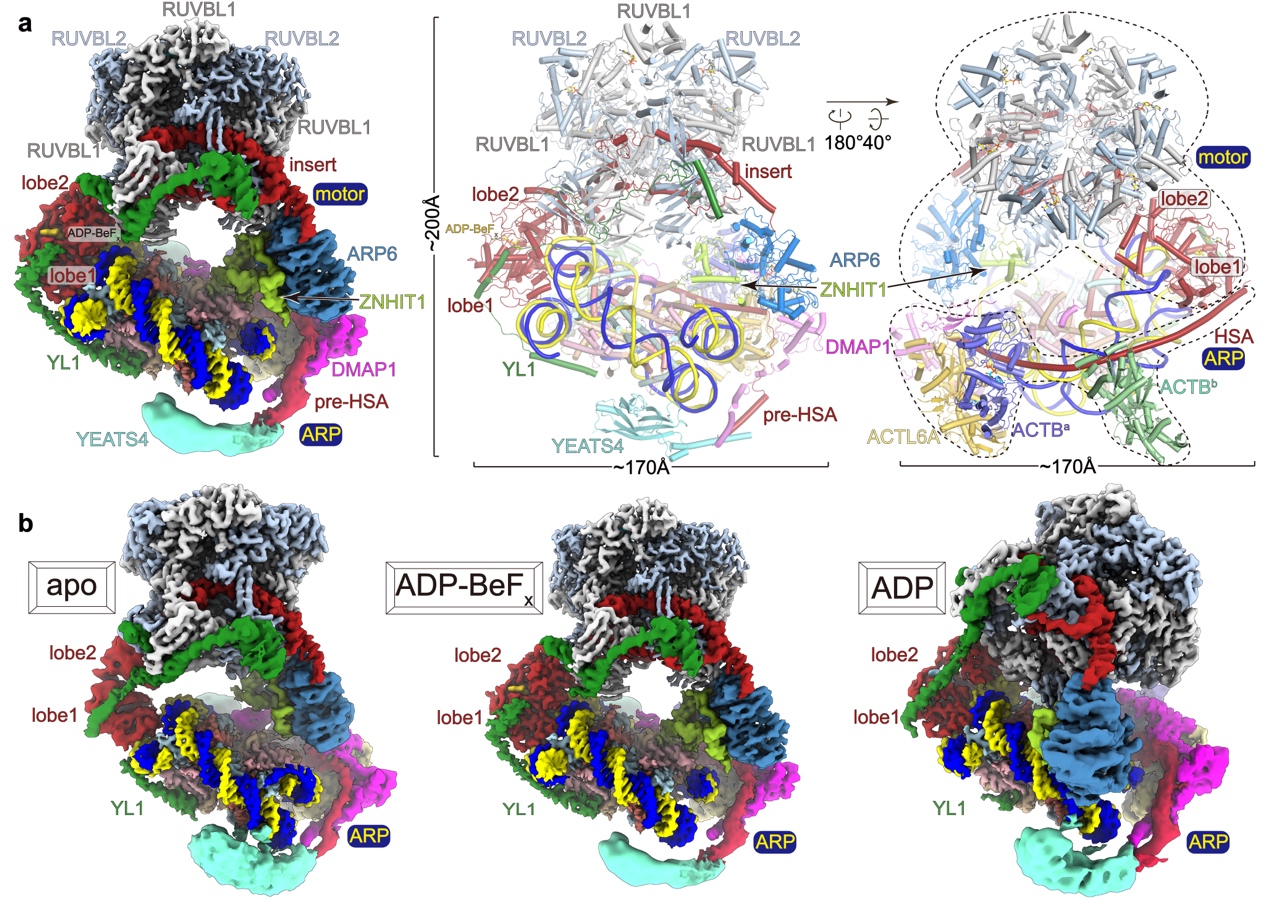
图1. a. ADP-BeFx结合状态下SRCAP-C-核小体的复合冷冻电镜重构密度图及三维模型。b. 三种核苷酸结合状态下SRCAP-C-核小体的复合冷冻电镜重构密度图。
通过结构比较,研究团队描绘出复合物由ADP-BeFx结合状态向ADP结合状态转变的动态过程(视频1),发现亚基ZNHIT1可能通过拉动H2A-H2B离开核小体来破坏H2A-H2B 的稳定性从而在H2A-H2A.Z置换过程中发挥关键作用。
视频1. ADP-BeFx结合状态向ADP结合状态转变时复合物的构象变化过程。
为了验证这一猜想,研究团队通过ChIP-seq技术研究了ZNHIT1对于细胞内H2A.Z分布的影响,结果表明ZNHIT1富含碱性氨基酸的N端区域是细胞中H2A-H2A.Z交换所必需的。根据结构比较和细胞内验证实验,并结合前人研究,研究团队提出了SRCAP-C介导的H2A-H2A.Z交换的工作机理。(图2)
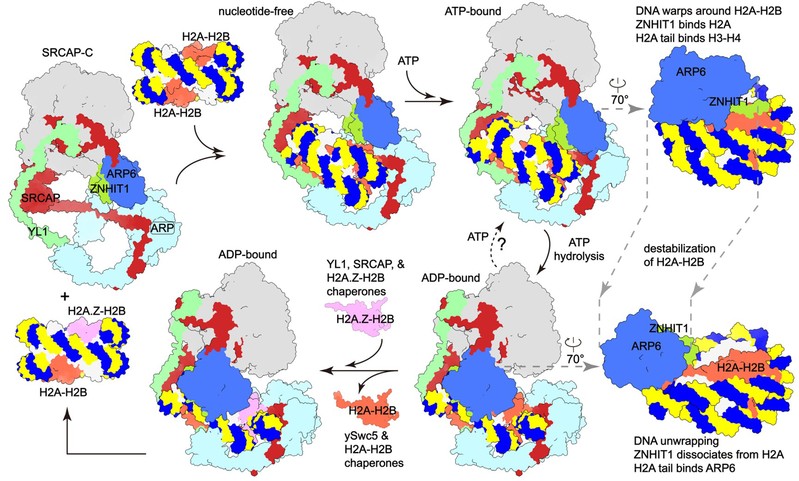
图2. SRCAP-C置换组蛋白的工作模型
这项工作首次解析了人源SRCAP-C结合核小体的结构,并通过分别捕捉其在ADP-BeFx和ADP结合状态下的结构,重构了SRCAP-C水解ATP的动态过程来揭示其工作机制,很好的解释了前人利用生物化学和单分子生物物理方法获得的结论,为全面解释H2A.Z置换的分子机理提供了理论指导。
复旦大学生物医学研究院2018级直博生余佳丽、2022级直博生隋烽瑞和2023级直博生谷峰为本文共同第一作者,复旦大学附属肿瘤医院研究员/生物医学研究院双聘研究员徐彦辉和粤港澳大湾区精准医学研究院青年副研究员王丽为共同通讯作者。
原文链接:https://www.nature.com/articles/s41421-023-00640-1