Adv Sci丨吴小华/黄胜林/胡治祥团队揭示转录因子KLF5促进卵巢癌进展和参与PARP抑制剂耐药调控的关键机制
非突变表观重编程(nonmutational epigenetic reprogramming)已成为肿瘤新的重要特征之一。非突变表观重编程是指肿瘤在不改变DNA序列的情况下,通过组蛋白的修饰、DNA甲基化等改变,引起基因组调控元件(启动子、增强子、超级增强子等)的活化以及染色质状态的重塑,最终引起基因功能发生可遗传的变化。近年来的研究不断证实,表观重编程导致的表观异常改变,驱动了肿瘤相关促癌转录本的转录组重塑,控制肿瘤发生发展和耐药等过程。
2023年9月13日,复旦大学生物医学研究院&附属肿瘤医院黄胜林课题组联合复旦大学附属肿瘤医院吴小华课题组发现了卵巢癌特异高表达的转录因子KLF5促进卵巢癌增殖和转移过程,并通过重塑同源重组关键基因RAD51的转录,促进卵巢癌PARP抑制剂耐药新机制,该工作以KLF5 Promotes Tumor Progression and Parp Inhibitor Resistance in Ovarian Cancer为题在线发表于Advanced Science杂志。

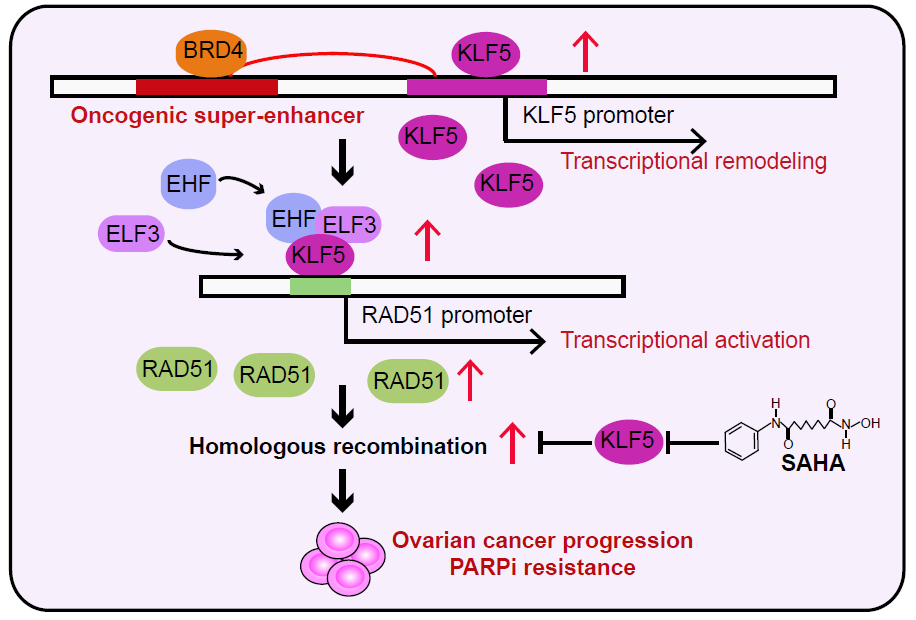
吴小华/黄胜林/胡治祥团队绘制了卵巢癌异常活化的超级增强子元件图谱,鉴定了一群在卵巢癌中不同亚型(高级别浆液性卵巢癌、卵巢透明细胞癌、卵巢子宫内膜样癌)异常活化的关键超级增强子元件,发现转录因子KLF5基因附近存在2个异常活化的超级增强子元件。通过体外实验证实该超级增强子促进了KLF5在卵巢癌中的高表达,同时发现KLF5通过结合在自身启动子元件上实现自我调控,进一步提升了KLF5在卵巢癌中的特异高表达。基于卵巢癌大样本队列,作者发现高表达KLF5的卵巢癌患者显示更差的预后。体内外实验证实KLF5促进卵巢癌的生长和转移过程。基于RNA-seq、ChIP-seq技术发现KLF5通过结合在RAD51启动子区域重塑RAD51的转录,进一步影响卵巢癌的同源重组信号通路。进一步,作者使用IP-mass实验发现KLF5与EHF和ELF3形成转录复合物,调控RAD51的转录过程。有趣的是,KLF5也能结合在ELF3的超级增强子区域以及EHF的启动子区域调控EHF和ELF3的转录,提示KLF5在这个转录复合物中扮演核心调控因子角色。临床上,同时高表达KLF5/EHF/ELF3的卵巢癌患者显示极差的预后,提示KLF5/EHF/ELF3是卵巢癌关键的预后标志物。鉴于同源重组通路是卵巢癌患者发生PARP抑制剂耐药的核心调控通路,作者推测KLF5参与卵巢癌患者的PARP抑制剂耐药过程。实验发现KLF5的高表达与卵巢癌细胞系对olaparib耐药呈现显著正相关。通过筛选一系列小分子化合物,作者发现HDACi家族抑制剂Suberoylanilide Hydroxamic Acid (SAHA)显著抑制KLF5的蛋白水平,并提升高表达KLF5的卵巢癌细胞对olaparib药物敏感性。通过体外克隆形成、裸鼠皮下成瘤以及PDX动物模型,作者发现SAHA联合olaparib是高表达KLF5同时对PARP抑制剂耐药的卵巢癌患者的潜在治疗手段,进一步拓展了基于表观遗传异常(而不依赖BRCA1/2突变)引起的olaparib耐药的卵巢癌患者的治疗方式。
复旦大学附属肿瘤医院主治医师吴勇,博士生陈思宇,研究助理邵杨为该论文的共同第一作者,胡治祥青年副研究员、吴小华教授、黄胜林研究员为本文的通讯作者。复旦大学生物医学研究院博士生苏颖、黎琴、复旦大学附属肿瘤医院博士生吴江春参与完成这项工作。该研究同时得到了复旦大学基础医学院/附属肿瘤医院朱军教授、温颢教授、黄妍教授、郑重教授、陈小军教授、居杏珠教授的大力支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202304638