Nat Commun丨屈前辉课题组与合作者报道糖基磷脂酰肌醇转酰胺酶与配体的复合物结构和自抑制机制
GPI(glycosylphosphatidylinositol ,糖基磷脂酰肌醇)修饰是真核生物中普遍存在的翻译后修饰。水溶性前体蛋白通过GPI修饰而锚定在细胞膜上,行使包括信号转导、催化、细胞黏附等在内的基本生物学功能。GPI-T是GPI锚定蛋白(GPI-AP)生物合成途径中的关键酶,它是一个五元跨膜复合物,负责将前体蛋白C端的信号肽切除并将脂分子GPI连接到新暴露的C末端。与大多数蛋白水解酶不同,GPI-T识别的肽段序列不具有序列唯一性,而仅有模糊的亲疏水排列特征。其切割位点(w位点)通常为侧链较小的氨基酸,切割位点至C末端疏水段由~10个亲水氨基酸残基的肽段相连(图1a)。如何实现底物宽泛性与催化保真性这一“矛盾统一体”,是GPI-AP生物合成中一个重要的生化机制问题。
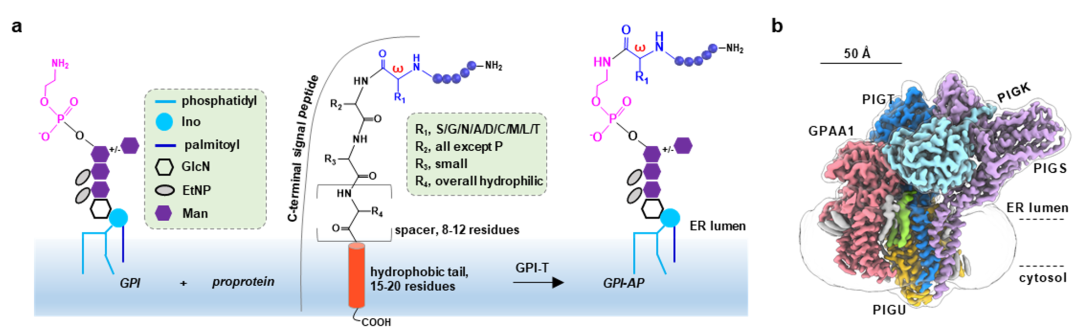
图1. GPI-T的冷冻电镜结构及其活性中心组成。a GPI-T催化反应及底物特征示意图。b GPI-T的冷冻电镜密度图。
研究组前期解析了人源GPI-T的2.53 Å冷冻电镜三维结构,揭示了其异源五聚体的组装机制(图1),该工作已于2022年5月发表在Nature Communications期刊(Nat Commun丨李典范/屈前辉/苏昭铭合作报道糖基磷脂酰肌醇转酰胺酶复合物的结构与底物识别机制)。但GPI-T在实现底物识别宽泛性的同时如何确保催化保真性的机制仍不明确。
2023年9月8日,中国科学院分子细胞卓越创新中心(上海生化与细胞所)的李典范课题组与复旦大学生物医学研究院的屈前辉课题组在Nature Communications上合作发表了题为Structures of Liganded Glycosylphosphatidylinositol Transamidase Illuminate GPI-AP Biogenesis的研究成果,揭示了糖基磷脂酰肌醇转酰胺酶复合物(GPI-T)识别广泛底物的结构基础和防止意外剪切的自抑制机制。该项工作入选“50篇展示论文”( https://www.nature.com/collections/hhfigaahch)。

为回答上述问题,研究团队拟进一步解析GPI-T与底物(前体蛋白、GPI)或者与产物(GPI-AP、信号肽)的复合物结构。由于结构异常复杂的GPI分子目前尚不能直接通过化学方法合成,研究团队设计了细胞工程与蛋白质工程方法。通过基因敲除与点突变相结合的手段,成功地捕捉到GPI-T复合体分别停留在“底物结合”和“产物结合”状态,解析了二者的高分辨率结构(图2a,2b)。在保真性上,GPI-T使用一个自抑制环锁定于非活性构象(图2c)。而且激活过程的构象变化需要打破数个氢键、盐键相互作用并引入电荷及亲疏水排斥。这种多重保护机制避免了因底物宽泛性而造成的意外水解。底物结合GPI-T时,信号肽与复合体的结合提供结合能,促使GPI-T亚基以刚性移动为主的构象变化,启动上述耗能的激活过程,打开自抑制环,同时,信号肽近催化部位的亲水部分通过诱导契合的方式,促使GPI-T催化中心的精确重构(图2d)。研究团队还设计了“功能增强突变体”以及“功能丧失突变体”,证明了所提出的自抑制与底物结合诱导的激活机制。此外,该工作还揭示了GPI-T识别宽泛性底物的结构基础和催化的生化机制。
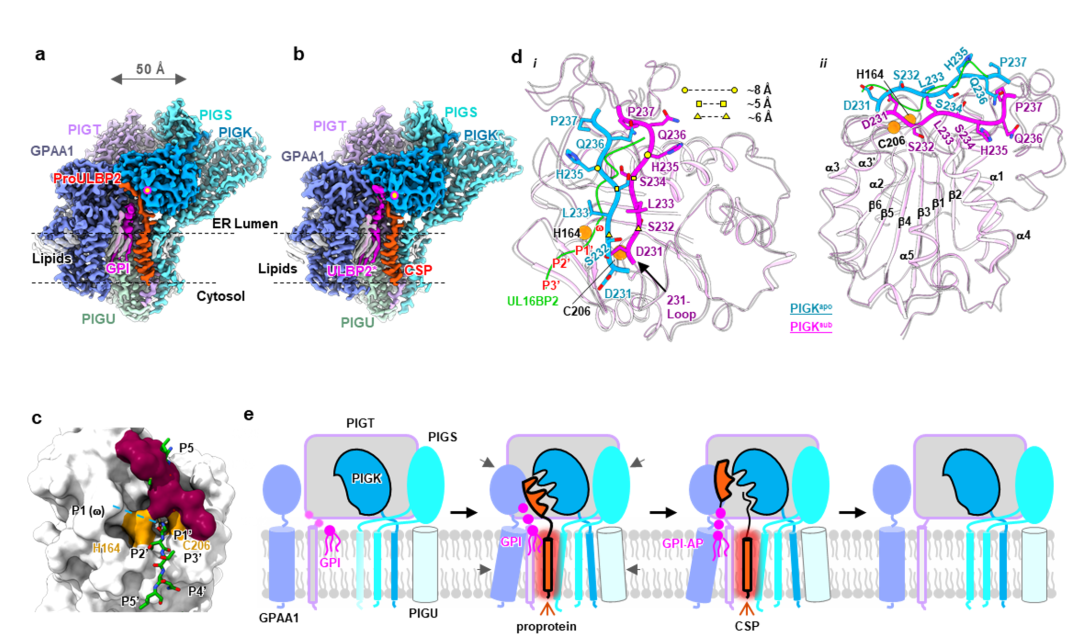
图2. GPI-T与底物、产物结合的结构揭示自抑制与激活机制。a, b GPI-T与底物 (a)、产物 (b) 的冷冻电镜密度图。c 自抑制环(红色)占据了底物(绿色)结合口袋。d GPI-T从自抑制状态(蓝色)向活性构象(洋红色)的构象变化。e GPI-T的激活过程。
该工作主要由中科院分子细胞科学卓越创新中心硕博连读研究生徐乙丹、博士后李婷婷,复旦大学生物医学研究院/附属口腔医院博士后周子璇等共同完成,博士研究生洪晶晶和晁钰琳,朱之妮同学,张颖教授等做了重要贡献。中科院分子细胞科学卓越创新中心研究员李典范和复旦大学生物医学研究院青年研究员屈前辉为该论文的共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-023-41281-y