Cell Research | 张琰青课题组解析人源有机阴离子转运体OATP1B1冷冻电镜结构
肝脏在人体中扮演着极为关键的角色,负责处理代谢产物、药物、毒素等,对于维持身体健康和代谢平衡至关重要。有机阴离子转运多肽(Organic Anion Transporting Polypeptides, OATPs)是一类在人体内参与介导转运多种内源性底物和多种外源性药物,对其吸收起关键作用的转运蛋白。OATP1B1是OATP家族中的重要成员,其特异性表达于肝细胞的基底侧膜,在肝细胞吸收和清除阴性或两性有机化合物的过程中扮演者不可或缺的角色,其底物具有广泛特异性,这些物质包括了胆汁盐、类固醇激素、他汀类药物、抗病毒类和抗癌药物等。在临床当中联合用药较为常见,如降血脂他汀类药物和抗高血压、抗生素、抗病毒等多种药物联合使用,而其中一些药物的使用可能会抑制OATP1B1的功能,从而导致他汀类药物过多地暴露于血液中,引发潜在横纹肌溶解以及生命危险等严重后果。由于其重要作用,FDA和EMA推荐体外测试用于评估OATP1B1参与的潜在药物-药物相互作用(drug-drug interaction, DDI)。OATP1B1功能的改变可能会对肝脏内药物代谢的药代动力学、药效学以及药物之间的相互作用产生影响。而长久以来,由于缺乏OATP家族的结构信息,OATP家族转运蛋白的结构和工作机制一直未被揭示。
2023年9月6日,复旦大学生物医学研究院张琰青团队在Cell Research杂志在线发表题为Cryo-EM structures of human organic anion transporting polypeptide OATP1B1的研究文章。该文章综合使用单颗粒冷冻电镜技术、分子动力学模拟以及功能转运实验,首次解析了OATP1B1和多种内源性底物以及外源药物的高分辨结构,揭示了OATP1B1与不同底物之间的结合模式,同时捕获了OATP1B1向外和向内开口的两种构象,为理解OATP1B1的转运机制提供了结构基础。

OATP1B1的总体结构由跨膜区和胞外区组成,跨膜区包括12根跨膜螺旋,分为N端 (NTD) 和C端 (CTD),NTD和CTD之间由一个胞内螺旋 (ICH) 连接。首先,研究人员通过外源表达纯化和单颗粒冷冻电镜的方法获得了向外开口的OATP1B1-apo的结构,为了进一步了解OATP1B1的底物结合和转运工作机制,研究人员解析了OATP1B1与代表性的内源性底物 (硫酸雌酮,E3S;胆红素,Bilirubin),外源性药物 (西咪匹韦,simeprevir) 以及荧光小分子 (2’,7’-二氯荧光素,DCF) 结合的复合物结构,在复合物结构中,研究人员基于电子云密度,同时利用分子对接、分子动力学模拟、分子生物学实验等方法,较为准确的搭建了小分子在蛋白质腔内的结合位置和形态(图1)。

图1. OATP1B1在apo状态以及与不同底物结合状态下的冷冻电镜密度图和分子模型图。

图2. OATP1B1底物结合模式。 a-d. 底物结合在F356、Y352和F386附近,根据其结合模式可分为major pocket和minor pocket两个结合位置。e,f. 分子动力学模拟发现底物与腔内F356、Y352和F386稳定结合,但腔内正电残基不直接参与底物结合,而是与周围负电残基配对,推测其可能对腔内电势调节起作用。g. 根据不同底物结合模式,归纳为正性结合位点(orthosteric site)和机会位点(opportunistic site)。h,i. 细胞荧光转运实验和[H3]-E3S体外脂质体转运实验。
有意思的是,在OATP1B1的腔内发现了两个不同的底物结合口袋:major pocket和minor pocket,其中较大的分子, Bilirubin和simeprevir结合在major pocket,而较小的分子,E3S和DCF结合在minor pocket(图2)。通过比较不同底物与氨基酸残基所发生的相互作用,并结合分子生物学实验数据、分子动力学模拟、同源序列分析比对,研究人员发现了Tyr352,Phe356和Phe386在小分子结合和转运过程中起到了较为重要的作用。
值得注意的是,不同于OATP1B1和其他底物结合时的向外开口构象,OATP1B1与E3S结合的复合物结构展现出向内开口的构象 (图3)。通过向外开口与向内开口构象的对比,研究人员发现了底物转运过程中细胞外侧和细胞内侧一系列盐桥和疏水作用门控位点。通过结构比对,研究人员推测底物结合引发TM7局部结构变化,联动NTD、CTD之间的胞内侧螺旋ICH刚性移动,类似于门闩打开,从而引发OATP1B1在转运过程中从向外开口变为向内开口的构象变化。
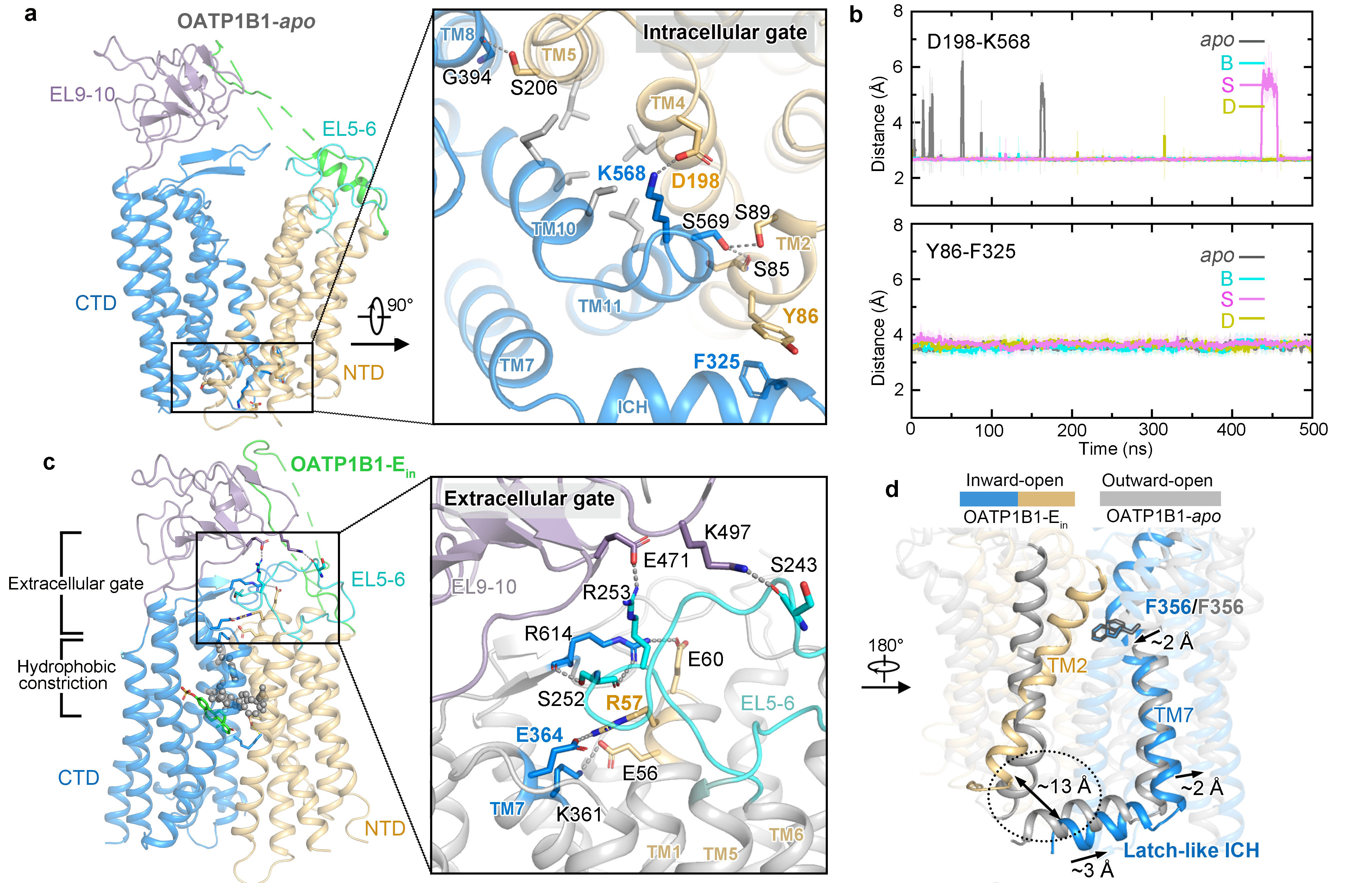
图3. OATP1B1的向外开口和向内开口的结构对比。a. OATP1B1-apo的胞内门控示意图。 b. OATP1B1-apo中胞内门控中两对相互作用的氨基酸残基的分子动力学模拟,显示了残基之间的稳定相互作用。c. OATP1B1-Ein中胞外门控示意图。d. OATP1B1-apo与OATP1B1-Ein的结构对比图,展示了TM7、TM2和ICH在构象变化中潜在的联动作用。
总的来说,OATP1B1结构的解析首次揭开了OATP家族转运蛋白的面纱,揭示了OATP1B1的工作机制,为相关的疾病治疗、药物研发提供了结构基础。
复旦大学生物医学研究院博士研究生闪紫阳、博士后杨雪梅,香港中文大学(深圳)博士后刘慧慧,清华大学生命科学学院助理研究员袁亚飞、博士研究生肖媛,复旦大学生物医学研究院博士后南京为本文的共同第一作者。复旦大学生物医学研究院张琰青研究员为本文的通讯作者。该工作冷冻电镜样品制备、筛选和采集在复旦大学冷冻电镜平台完成。该研究得到了国家自然科学基金、国家重点研发计划、上海科技启明星、复旦大学原创研究计划项目、复旦大学和复旦大学附属上海市第五人民医院启动经费,以及深圳自然科学基金的资助。
原文链接:
https://doi.org/10.1038/s41422-023-00870-8
附复旦大学生物医学研究院张琰青实验室招聘启事:
张琰青课题组研究方向为利用冷冻电子断层技术(cryo-ET)和冷冻电镜单颗粒技术,研究跨尺度生物大分子的结构与功能。课题组近年来承担国家自然科学基金面上、上海启明星、参与国家重点研发等项目,招聘博士后、科研助理、博士生等,长期有效。求职者可发送相关材料“个人简历、代表性论文”发至邮箱:zyq_lab@fudan.edu.cn。