Cell Research | 程净东团队揭示剪接体质量控制的机制
由剪接体催化的mRNA剪接是所有真核生物基因表达中的关键步骤之一。剪接体是一个分子量高达1.5兆道尔顿、结构复杂且高度动态的RNA-蛋白质复合物,包含数十种蛋白质和5种小核RNA(snRNAs)。随着冷冻电镜技术的进步,研究人员已经解析了酵母和人类主要剪接体的多个基本构象,揭示了剪接体在组装、激活、催化剪接以及最终解离过程中的分子机制。为了确保剪接过程的精准性,剪接体需要识别并及时丢弃异常的剪接底物。虽然已有多个因子被报道参与这一质量控制过程,但剪接质量控制的具体分子机制仍然未知。
2025年2月28日,复旦大学生物医学研究院程净东课题组与合作者在Cell Research在线发表了题为Structural insights into spliceosome fidelity: DHX35–GPATCH1 mediated rejection of aberrant splicing substrates的研究论文,鉴定并揭示了剪接过程中DHX35–GPATCH1参与识别及丢弃异常剪接底物的质量控制的机制。

该工作解析了来自嗜热毛壳菌(Chaetomium thermophilum)处于质量控制过程中全新的剪接体B*Q状态复合物结构。此类复合物由于5’剪接位点异常凸起的构象而被阻滞在催化激活状态,但是尚未完成第一次剪切反应。GPATCH1蛋白识别到异常凸起的5’剪接位点并结合在剪接体上,随后招募RNA解旋酶DHX35到剪接体上将U2/分支点RNA双链进行解旋,从而阻碍剪接反应的进行。除此之外,解离因子RNA解旋酶DHX15(Prp43)在B*Q状态中也结合在底物U6 snRNA的3’端,为被TFIP11激活后促进剪接体的解离做好准备。本研究确定了DHX35及其激活蛋白GPATCH1是此类质量控制过程中的关键蛋白,这也是首次在结构中证实了DHX35的底物是U2 snRNA。该研究结合结构信息和生化实验结果,揭示了两种RNA解旋酶通过协同合作来驱动含有异常剪接底物的剪接体进行解离来维持剪接保真度的质量控制机制。
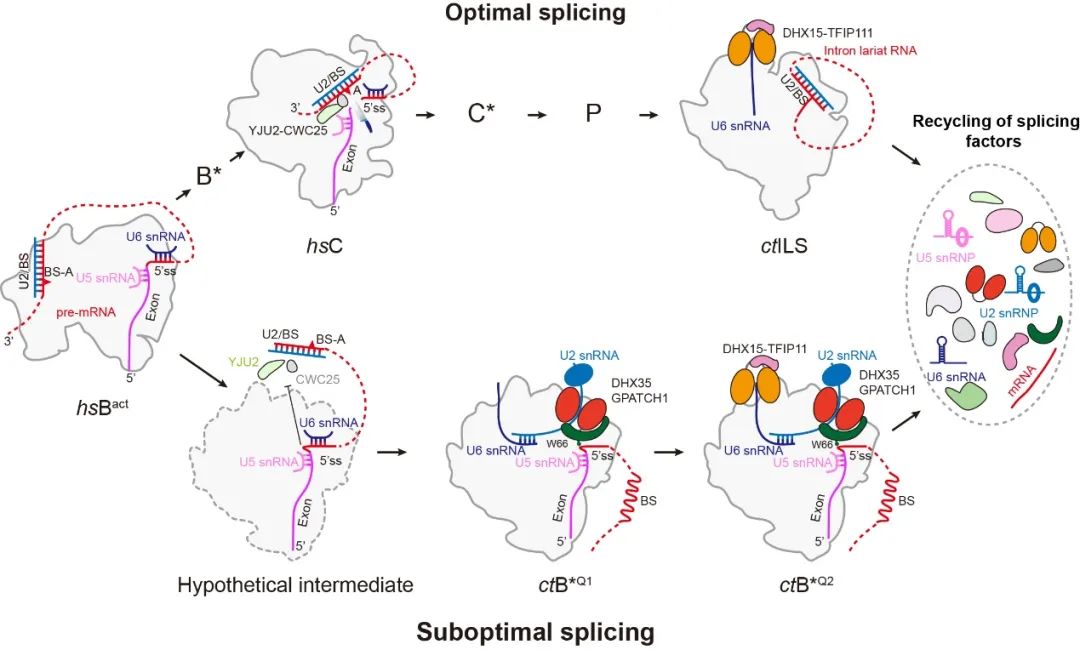
DHX35和DHX15驱动异常剪接体解离来维持剪接保真度
复旦大学生物医学研究院博士后李毅博士和博士生王梦娇、海德堡大学生物化学中心博士后Paulina Fischer为该论文的共同第一作者,复旦大学生物医学研究院和附属闵行医院程净东青年研究员和海德堡大学生物化学中心Ed Hurt教授、EMBL Benjamin Lau博士为该论文共同通讯作者。本研究还得到了马普所Reinhard Lührmann教授和复旦大学陈飞教授的大力支持。
原文链接:
https://doi.org/10.1038/s41422-025-01084-w