蓝斐团队《Cell Reports》报道METTL5调控核糖体翻译并促进肿瘤生长
核糖体是生命体内提供蛋白合成的巨大机器,它由多种核糖体蛋白与核糖体RNA组成,是实现遗传物质表达的重要场所。蛋白翻译是一个高度精细的调控过程,在这个过程中多种rRNA修饰参与其中,无论是细菌、酵母还是多细胞生物,均有研究证明核糖体RNA修饰对生物体的翻译和生长有影响。随着近年来高分辨率核糖体结构的解析,人们发现了更多的多细胞生物特有的rRNA修饰位点,这些修饰的调控酶以及对翻译的影响尚未可知,特异存在于多细胞生物中的功能和意义需要更多研究来阐释。
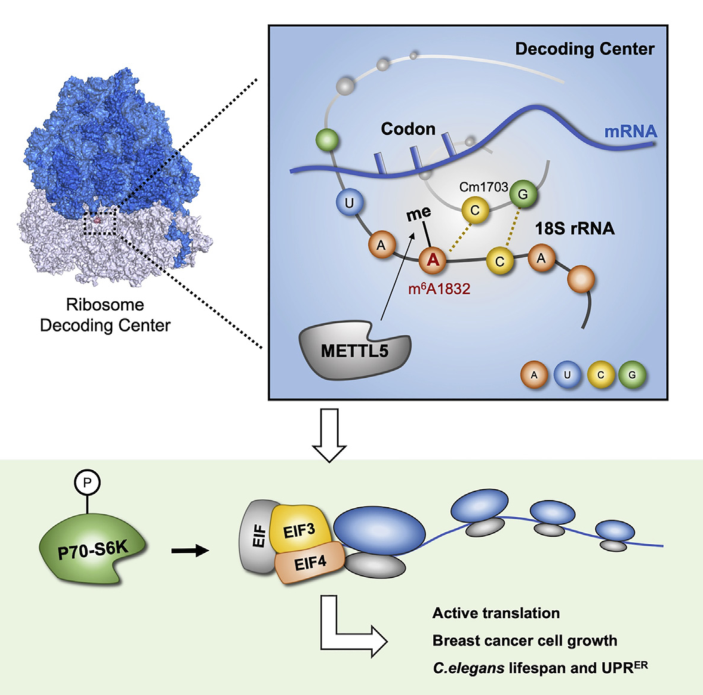
哺乳动物的核糖体RNA上存在两个m6A修饰位点,分别位于大亚基28S A4220位和小亚基18S A1832位。此前人们对mRNA上的m6A修饰研究较多,发现了催化mRNA上m6A修饰的调控酶与识别子,揭示了m6A修饰对于mRNA代谢活动中的重要性,并研究其在胚胎发育、肿瘤、生殖等多种生物学过程中的作用和意义。但是对核糖体RNA上的m6A修饰的调控,直到近两年才有文章报道。
2020年12月22日,我院蓝斐团队在Cell Reports上报道了题为Ribosome 18S m6A Methyltransferase METTL5 Promotes Translation Initiation and Breast Cancer Cell Growth的文章,研究了18S rRNA m6A1832的甲基转移酶METTL5的底物序列特异性,证明了METTL5能够调控核糖体翻译,促进乳腺癌肿瘤细胞生长,在线虫中调控压力应激、寿命以及内质网未折叠蛋白应激反应。

研究团队通过体外酶活实验,明确了METTL5对18S rRNA A1832位点具有特异性催化,而对已知的METTL3/METTL14复合物偏好的RNA底物没有催化活性。在HEK293T细胞内敲除METTL5,质谱检测同样发现18S rRNA的m6A含量几乎消失,而在mRNA (polyA+) 以及28S rRNA中,m6A含量未见明显变化。
已知18S A1832位点位于核糖体的编译中心(Decoding Center),为了解释m6A1832修饰在哺乳动物中存在的特殊意义,研究人员寻找了哺乳动物以及酵母和细菌的高分辨率核糖体电镜结构(酵母和细菌二者相对应的A位点不发生m6A修饰,可作为较好的参照)。比对酵母和细菌的编译中心,含有m6A修饰的人A1832距离mRNA密码子骨架的+2位磷酸根更近,很可能是由于N6位的一个氢离子被甲基取代后,导致的18S rRNA内部配对强度改变而造成。而这一空间构像的差异,也很可能影响了核糖体的翻译活性。针对这一假想,研究者通过polysome profiling、AHA-Click、双荧光素酶报告系统等实验,证明了在METTL5缺失的细胞整体翻译水平下降。生化试验进一步证实翻译起始因子与成熟核糖体结合减弱,与翻译起始相关的p70-S6K磷酸化水平降低,细胞内整体翻译效率降低。
前期研究证实核糖体翻译和细胞生长状态密切相关,尤其是肿瘤细胞需要大量蛋白合成满足生长增殖的需求,那么METTL5对于肿瘤生长是否有促进作用?在TCGA分析中,METTL5在多种肿瘤中存在拷贝数增加现象,研究团队选取了乳腺癌进行研究,在多组临床样本中,METTL5表达量在肿瘤组织高于癌旁组织。通过特异性RNAi敲低多种乳腺癌细胞系中的METTL5,可见p70-S6K磷酸化水平降低,同时细胞生长受抑制,在多种乳腺癌细胞系中敲低METTL5细胞凋亡明显增加。
为了在生物体水平上研究METTL5蛋白的功能,研究团队在线虫中敲除metl-5(线虫中的同源基因),发现METL-5同样特异性调控线虫体内18S rRNA m6A1717修饰。研究者诧异的发现METL-5缺失似乎并未给线虫造成什么负面影响,而是突变体线虫寿命延长、耐热性提高,并伴随内质网应激反应(ER-UPR)的提高。而这些表型与已知的线虫中核糖体功能受损表型较为一致,暗示METL-5在线虫中发挥保守的功能,调控了核糖体翻译功能。
关于METTL5作为18S rRNA m6A甲基转移酶的研究,2020年已有多篇文章独立报道其酶活性,并在多种生物学系统中研究(比如mESC分化、小鼠胚胎发育、线虫耐受、果蝇行为等方面),相比于其他文章,本论文着重研究了METTL5的底物序列特异性和对于肿瘤细胞生长的影响。值得一提的是,其它同期文章中均未发现METTL5对于细胞生长的影响,但本研究却报道了肿瘤细胞生长表型,而它能否成为治疗肿瘤的靶点目前还在进一步研究中。而线虫研究的结果也很有意思,虽然生命本身离不开蛋白翻译,但一定程度上干扰翻译活性,很可能获得有益的性状。
复旦大学生物医学研究院荣博文和中科院遗传与发育生物学研究所张茜为共同第一作者。复旦大学蓝斐研究员、中科院遗传与发育生物学研究所田烨研究员和同济大学医学院马红辉研究员作为共同通讯作者。
原文链接:https://doi.org/10.1016/j.celrep.2020.108544