柳素玲团队《Nature Communications》发现三阴性乳腺癌相关靶点
三阴性乳腺癌(Triple-negative breast cancer,TNBC)因缺乏激素受体和HER2蛋白的表达,目前有效的治疗手段仍十分有限。肿瘤新血管形成(Neovasculogenesis)在三阴性乳腺癌发生发展中发挥重要作用,靶向肿瘤血管是三阴性乳腺癌治疗的一个重要策略。肿瘤血管系统是一个十分复杂的网络系统,包括内皮血管新生(angiogenesis)和肿瘤血管拟态(vasculogenic mimicry)等,而目前绝大部分抗血管新生临床治疗策略都是靶向VEGF/VEGFR信号通路,并不能很有效的针对肿瘤血管拟态,因此寻找能够有效靶向肿瘤血管拟态的分子靶点是三阴性乳腺癌抗血管治疗的一个重要方向。
2021年7月20日,我院柳素玲团队在Nature Communications杂志在线发表了题为TEM8 marks neovasculogenic tumor-initiating cells in triple-negative breast cancer的研究性论文,揭示了三阴性乳腺肿瘤干细胞特异性高表达肿瘤内皮细胞标志蛋白TEM8(Tumor Endothelial Marker 8),通过激活RhoC/ROCK1/SMAD5信号通路,从而增强肿瘤细胞干性和血管拟态形成能力,为基于TEM8及其下游信号通路开发针对三阴性乳腺癌的新治疗策略提供了有力的证据。

为寻找在三阴性乳腺癌新血管形成过程中的关键分子,作者通过对三阴性乳腺癌患者的癌和癌旁临床样本进行RNA测序,并与两例血管形成相关基因数据集进行比对分析后发现TEM8在三阴性乳腺癌中高表达。TEM8蛋白是一个在多种物种中均高度保守的I型跨膜糖蛋白。对大量乳腺癌患者肿瘤样本染色结果显示TEM8的表达水平与肿瘤血管密度(尤其是血管拟态密度)显著正相关,体内外实验发现TEM8显著促进乳腺癌细胞血管拟态形成。此外,进一步研究该蛋白特性时他们发现TEM8特异性高表达于三阴性乳腺肿瘤干细胞中。以往研究报道显示ALDH+三阴性乳腺肿瘤干细胞具有一定的血管拟态形成能力,在本研究中他们发现只有高表达TEM8蛋白的ALDH+三阴性乳腺肿瘤干细胞具有极强的血管拟态形成能力和致瘤能力。
机制上,他们发现TEM8促肿瘤细胞血管拟态和干性的功能依赖于其胞内段结构域,其通过胞内段结构域招募RhoC和GNAS蛋白,GNAS蛋白可以识别并结合到RhoC的RhoGAP蛋白结合位点,从而阻断了RhoC信号的失活,导致胞内RhoC/ROCK1信号增强。而ROCK1激酶可直接磷酸化并激活SMAD5信号,最终促使肿瘤细胞血管拟态能力和干性增强。体内外实验进一步证明敲低SMAD5分子或者使用ROCK1特异性抑制剂Y-27632处理三阴性乳腺癌细胞后TEM8过表达引起的血管拟态和细胞干性增强现象被显著回补。此外,他们发现乳腺癌细胞中TEM8蛋白可被E3泛素连接酶ASB10泛素化修饰从而降解。目前关于ASB10的研究报道仍较少,他们发现乳腺癌细胞中ASB10的表达受雌激素受体ERα转录调控,因三阴性乳腺癌细胞缺乏ERα表达,ASB10的低表达部分解释了TEM8在三阴性乳腺癌细胞中高表达的原因。
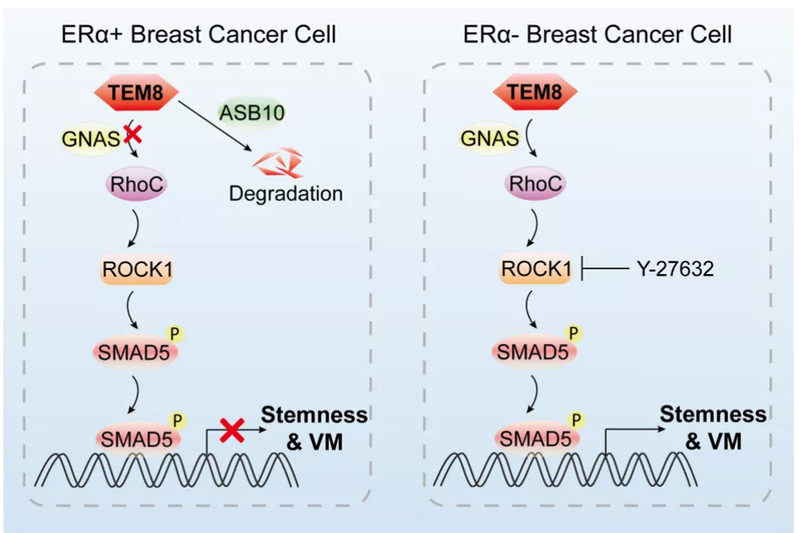
另外他们利用来自临床三阴性乳腺癌患者的异种移植瘤模型评估了TEM8/RhoC/ROCK1/SMAD5通路作为三阴性乳腺癌治疗靶点的效果。结果显示,ROCK1抑制剂Y-27632单独施加可对高表达TEM8的三阴性乳腺癌体内生长和血管拟态形成具有很好的抑制作用,而与化疗药物多西他赛联合使用不仅具有更明显的肿瘤生长和血管拟态形成抑制效果,还可以显著抑制因多西他赛治疗引起的肿瘤干细胞富集现象。总结来看,本研究表明TEM8特异性高表达于三阴性乳腺肿瘤干细胞上,通过招募RhoC和GNAS蛋白,抑制RhoC的失活,增强RhoC/ROCK1信号,ROCK1直接磷酸化SMAD5,从而SMAD5信号通路被激活,最终导致肿瘤细胞血管拟态和干性增强,促进肿瘤的发生发展。靶向TEM8及其通路可以实现同时靶向肿瘤血管拟态和肿瘤干细胞群体,为三阴性乳腺癌的治疗提供了有效靶点。
复旦大学附属肿瘤医院博士研究生许佳慧为论文第一作者;复旦大学生物医学研究院/附属肿瘤医院柳素玲教授,复旦大学附属肿瘤医院张立行副研究员,中科院上海生物化学与细胞生物学研究所胡荣贵教授和中国人民解放军陆军军医大学卞修武教授为本文的共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-021-24703-7