Cell Research丨孙蕾团队与合作者报道奥密克戎中和抗体诱导刺突蛋白产生“双三聚体”结构从而抑制病毒感染的新机制
新冠病毒持续变异,目前在人群中流行的主要的奥密克戎及其变体,由于其在刺突蛋白(Spike S)上的突变众多,对既往感染者或者疫苗接种者血清的中和抗体产生了严重的免疫逃逸,处于临床阶段的新冠中和抗体药物对Omicron突变株活性也大大降低。因此,亟需开发出新的中和抗体,为当前新冠肺炎疫情的防治提供药物储备。
2022年6月29日,复旦大学生物医学研究院孙蕾研究员与复旦大学黄竞荷研究员、上海交通大学附属仁济医院吴凡研究、广州医科大学附属第一医院赵金存教授合作在Cell Research线上发表题为“A broadly neutralizing antibody against SARS-CoV-2 Omicron variant infection exhibiting a novel trimer dimer conformation in spike protein binding”的研究论文。该研究发现了一株对包括Omicron在内的新冠主要突变株具有强效中和活性的全人源单克隆中和抗体,该抗体能诱导新冠表面刺突蛋白形成双三聚体(Trimer dimer),导致病毒颗粒聚集从而抑制病毒与宿主受体结合,获得广谱且强效的中和效果。

研究团队利用B细胞单克隆培养和高通量功能性抗体筛选开发技术,从一名新冠病毒感染的康复患者的B细胞中,鉴定出一株强效中和抗体6M6。抗体6M6可以结合SARS-CoV-2以及Omicron的刺突蛋白三聚体和RBD,亲和力常数达到nM级别。假病毒与活毒中和实验结果显示,6M6能强效中和奥密克戎、SARS-CoV-2及其它VOC突变株,这些数据显示6M6具有广谱中和活性。
研究团队进一步利用竞争结合实验研究6M6的结合位点,发现6M6与S309的表位重叠,处于RBM区域以外,不与ACE2竞争结合SARS-CoV-2的RBD,然而当6M6与Omicron刺突蛋白三聚体相互作用后,Omicron刺突蛋白三聚体却不能结合ACE2,其中的分子作用机制是什么呢?
研究团队利用冷冻电镜(Cryo-EM)技术解析了6M6与Omicron刺突蛋白三聚体高分辨率三维结构,发现约有30%的蛋白颗粒在6M6 IgG分子诱导下产生了“双三聚体”结构,三个6M6 IgG分子与两个S三聚体交联,其中6个6M6的抗原结合片段(Fab)分别与6个RBD相互作用,使天然处于 down-down-up 状态的RBD变成up-up-up RBD, 从而扩大抗体与RBD的接触面积,增加与RBD的结合亲和力,拉近了两端的RBD距离,形成双三聚体。6M6在Omicron RBD的作用表位集中在K356、S349、A352、N450、E340、N343、R346、N354、R466、Y351、N481。6M6的Fc端对双三聚体形成起了重要作用,用木瓜蛋白酶切掉6M6的Fc端,余下的6M6(Fab’)2分子与Omicron刺突蛋白三聚体不能产生双三聚体结构。6M6诱导刺突蛋白形成稳定的“双三聚体”结构,从而使Omicron病毒粒子聚集产生空间位阻,阻止RBD与受体ACE2识别,这解释了6M6这类不与ACE2竞争结合RBD的抗体抑制病毒感染的新机制。
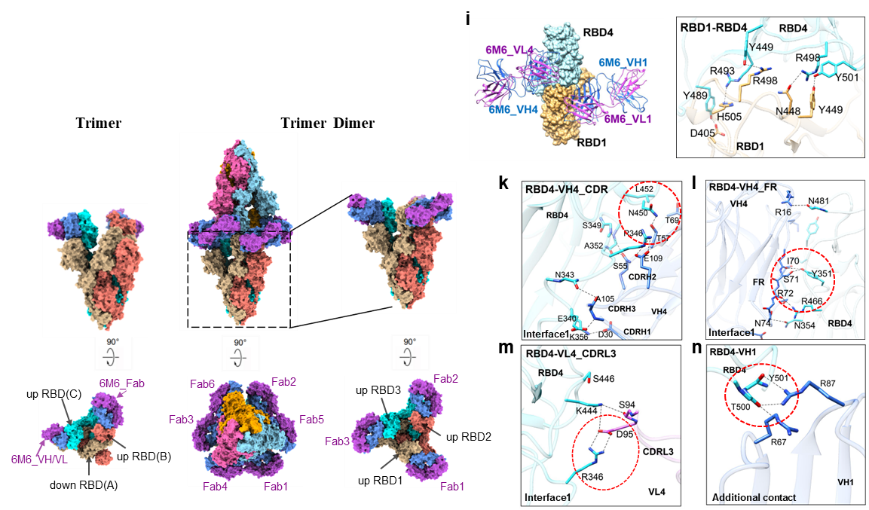
为了进一步6M6的关键识别表位,研究团队对6M6表位的氨基酸进行丙氨酸突变,构建了包括Omicron刺突蛋白突变在内的54个单点突变假病毒株,实验结果显示,6M6在RBD上的关键作用位点是R346, Y351, N450, L452, R466,而主要引起Omicron逃逸大部分中和抗体的S371L单点突变对6M6敏感。
综上所述,本研究开发了一株能抗包括Omicron毒株在内的新冠突变株的广谱中和抗体,解析了该抗体与刺突蛋白复合物的结构,揭示了一种新的中和作用机制,即抗体IgG分子通过交联刺突蛋白形成双三聚体来诱导病毒颗粒的聚集,从而阻碍病毒与宿主细胞受体结合。
复旦大学基础医学院医学分子病毒重点实验室、上海市重大传染病和生物安全研究院、上海市公共卫生临床中心黄竞荷研究员,上海市重大传染病和生物安全研究院、复旦大学附属第五人民医院、复旦大学生物医学研究院孙蕾研究员,上海交通大学附属仁济医院上海免疫学研究所吴凡研究员,广州医科大学附属第一医院赵金存教授为该研究的共同通讯作者。复旦大学王应丹、詹屋强、刘江艳,广州医科大学王延群为该研究的共同第一作者。该研究得到了上海市科技重大专项、国家自然科学基金、国家科技部、国家科技重大专项、上海市卫生健康委、中国医学科学院、复旦大学附属上海第五人民医院人才计划经费支持。
原文链接: