徐彦辉/陈飞合作团队《Science》报道新的转录调控复合物INTAC并揭示其结构和功能
基因表达的精密调控,对生命体的形成、发育以及各种生物学功能的维持至关重要;基因表达的紊乱与各种疾病的发生息息相关。尽管过去围绕基因的转录调控机制已经有相对清晰的认识,然而围绕RNA聚合酶II 的C端结构域(CTD)的动态调控特别是转录抑制机制仍然知之甚少。
2020年11月27日,我院徐彦辉团队与陈飞团队合作在Science杂志发表了研究长文(Research Article)“Identification of Integrator-PP2A complex (INTAC), an RNA Polymerase II phosphatase”。该项研究发现了一个全新的转录调控复合物 INTAC(包含16个蛋白亚基,总分子量近1.5兆道尔顿),解析了INTAC的高分辨冷冻电镜结构,揭示了INTAC作为一个双功能酶同时具备RNA剪切和去磷酸化活性,可去除Pol II的多个CTD磷酸化位点发挥转录抑制功能。该项研究首次发现PP2A这一最重要的磷酸酶可直接调控转录,突破了以往的相关认知,拓展了磷酸酶与转录调控这两个重要研究领域的研究范畴。

Integrator复合物含有14个亚基(分子量1.4兆道尔顿),能够通过结合Pol II剪切多种RNA并调控转录。研究团队在开展Integrator结构研究过程中,发现Integrator和PP2A核心酶(PP2A-AC)有较强的相互作用。通过系统生化和结构研究,验证了二者形成稳定的功能复合物,并将其命名为INTAC(Integrator-containing PP2A-AC),属于非经典的PP2A全酶复合物(见下图右上)。
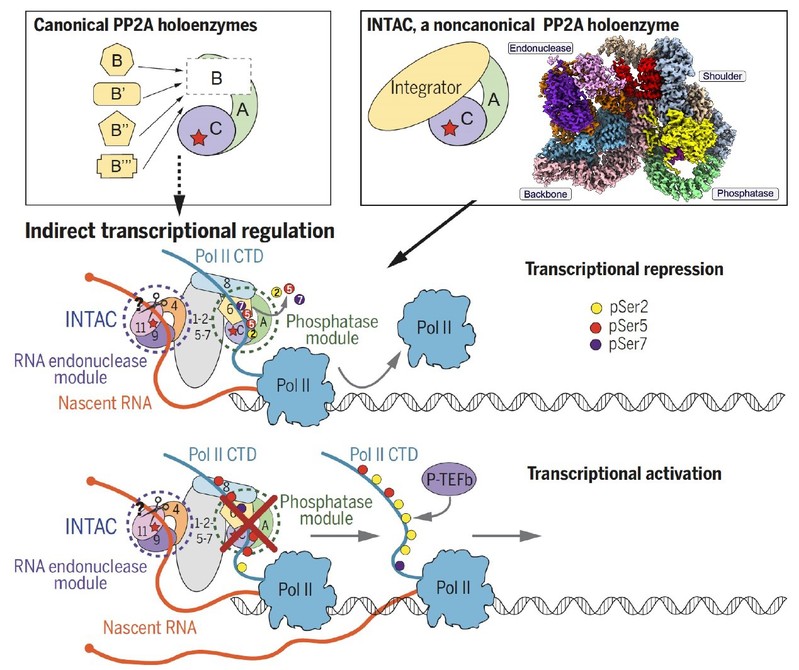
图注:INTAC复合物的分子组成和工作模型。(左上)经典的蛋白磷酸酶2(PP2A全酶)的分子组成示意图,A、B和C分别代表PP2A全酶的结构亚基,调节亚基和催化亚基。PP2A全酶可间接调控转录。(右上)INTAC复合物的分子组成示意图和电镜密度图。复合物由四个模块组成,可直接调控转录。(底部)INTAC复合物结合RNA聚合酶Pol II并去除Pol II CTD的第2、5和7位丝氨酸的磷酸化,进而抑制转录过程。而磷酸酶活性的损失则增加了Pol II磷酸化的水平,从而导致INTAC目标基因失调的转录。
PP2A是人体中最重要的蛋白质磷酸酶之一,在某些组织中其含量甚至达到总蛋白量的1%。在细胞内调控多种生命过程并参与多种疾病的发生,但以往没有PP2A直接参与转录调控的报道。研究团队解析了INTAC的高分辨结构(整体分辨率3.5 Å),发现核酸酶(Endonuclease)和磷酸酶(Phosphatase)这两个催化模块分布在核心的骨架模块两侧。进一步的生化研究发现,INTAC中的PP2A-AC去除Pol II CTD磷酸化并抑制转录活性。其中Integrator作为非经典的调控亚基,招募Pol II,使PP2A-AC发挥去磷酸化活性。INTAC的磷酸酶与核酸酶的活性分别调控转录的不同过程,即核酸酶活性主要调控基因的启动子近端终止,而去磷酸化酶活性则能够同时抑制暂停Pol II的释放和转录延伸。
总的来说,该项工作明确了PP2A直接调控基因转录,不仅拓展了转录调控和PP2A相关领域的研究边界,还对靶向PP2A的药物开发提出了重要的指导。特别需要指出的是,以往基于PP2A的靶向药物开发都只关注其参与信号转导调控的作用,后续的靶向药物开发就需要从该研究中获得启示考虑到其直接调控转录的功能。
值得一提的是,上述工作也是徐彦辉课题组继2020年初在Science上发表研究长文揭示人源BAF复合物的染色质重塑机制之后,在转录调控相关结构功能研究中取得的又一次重大成果。
博士后郑海、生物医学研究院2017级博士生戚轶伦、研究助理胡士斌博士、博士后徐从玲、中科院上海营养与健康研究院博士后曹璇为本文共同第一作者,徐彦辉和陈飞为共同通讯作者。
原文链接:https://doi.org/10.1126/science.abb5872