屈前辉课题组分别在《Structure》 & 《Immunity》上报道Patch1研究及EB病毒vGPCR研究
细胞表面跨膜蛋白Patched(Ptc1)介导的Hedgehog (Hh)信号传递是调控动物形态发生的重要通路,其功能失调往往导致机体发育异常,且与基底细胞癌等恶性肿瘤的发生密切相关。穿膜12次的Ptc1蛋白主要分布于初级纤毛上。当没有配体Hh存在时,Ptc1可以通过降低细胞膜中的固醇类分子水平来抑制Hh信号通路及下游基因的转录表达。感应到Hh信号后,Ptc1从初级纤毛中向纤毛基底部位迁移,并富集于质膜小窝(caveola)上。质膜小窝膜上富含鞘磷脂与胆固醇,是一种相分离形成的“信号传递枢纽”。Ptc1蛋白在去垢剂胶束等非脂环境的三维结构的解析为阐释该受体发挥功能的机制提供了重要线索,然而它在天然脂环境中的构象状态并不清楚。单分子荧光实验表明,Ptc1在质膜小窝中以聚集形式存在,可能与其需要高效招募配体、共受体及下游效应蛋白有关。
2021年6月25日,复旦大学生物医学研究院屈前辉青年研究员与中科院分子细胞科学卓越创新中心(上海生化与细胞所)的李典范/赵允/丛尧课题组合作在Structure上发表论文,报道了重构在脂纳米盘(lipid nanodisc)里的Ptc1蛋白的冷冻电镜结构及功能研究。

采用一定比例的磷脂和胆固醇混合物模拟天然的脂膜环境,研究者对Ptc1蛋白进行了组装,并利用单克隆冷冻电镜技术解析了该脂环境中Ptc1的三维结构。分析显示其与去垢剂胶束等非脂环境中解析的Ptc1结构整体类似,不过局部存在一些有意思的差别。比如,作为胆固醇转运通道的一部分,Ptc1的固醇感知结构域(SSD)附近的跨膜区比之前的结构更加紧密。而在胞外的固醇释放位点附近区域则表现出较高灵活性。这些区别可能与固醇类化合物的转运和释放有关。
重构于nanodisc中的Ptc1蛋白颗粒二维及三维重构结果,及与已知单体模型(去垢剂胶束中)的结构区别。下方显示三种不同的二聚体状态及对应的质膜弯曲程度。
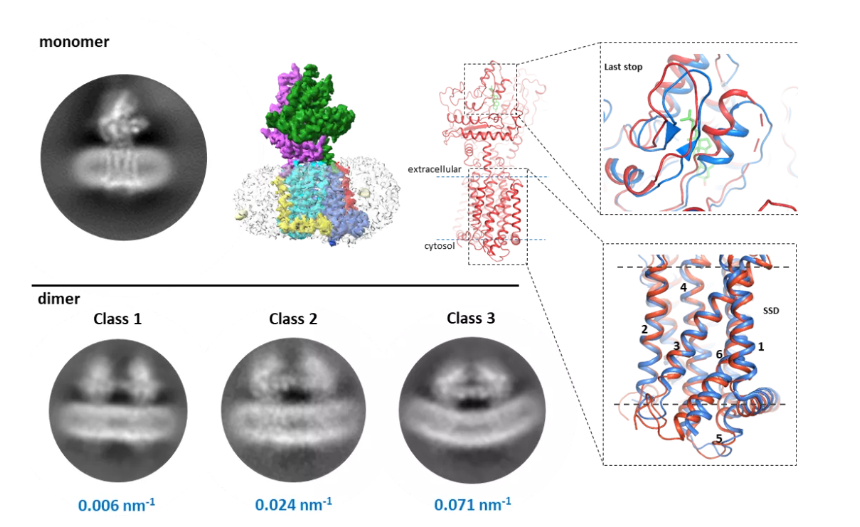
本研究还发现脂纳米盘中的Ptc1存在多种之前未被报道的二聚体状态,且这些二聚状态与膜曲率相关。其中弯曲程度最大的二聚体,其膜曲率与天然状态下质膜小窝的曲率近似。因为脂纳米盘本身不具有曲度,因此这些弯曲的膜结构可能是Ptc1二聚体所介导形成的。该结果提示,膜蛋白功能可受到脂环境的影响,但膜蛋白也能通过影响脂膜的物理与化学特征进而发挥功能。
相关论文信息:https://doi.org/10.1016/j.str.2021.06.004
此外,屈前辉青年研究员与斯塔福大学Chris Garcia团队对EB疱疹病毒(Epstein-Barr virus)上的一种独特的G蛋白偶联受体(GPCR)蛋白BILF1的结构与功能进行了研究。据统计,全世界有超过90%的人感染过EB病毒。该病毒是多种癌症如鼻咽癌的主要致癌因素之一。EB病毒可长期潜伏于人体内而不被免疫系统彻底清除,因而阐明EB病毒逃逸免疫机制对于癌症的防治尤为重要。
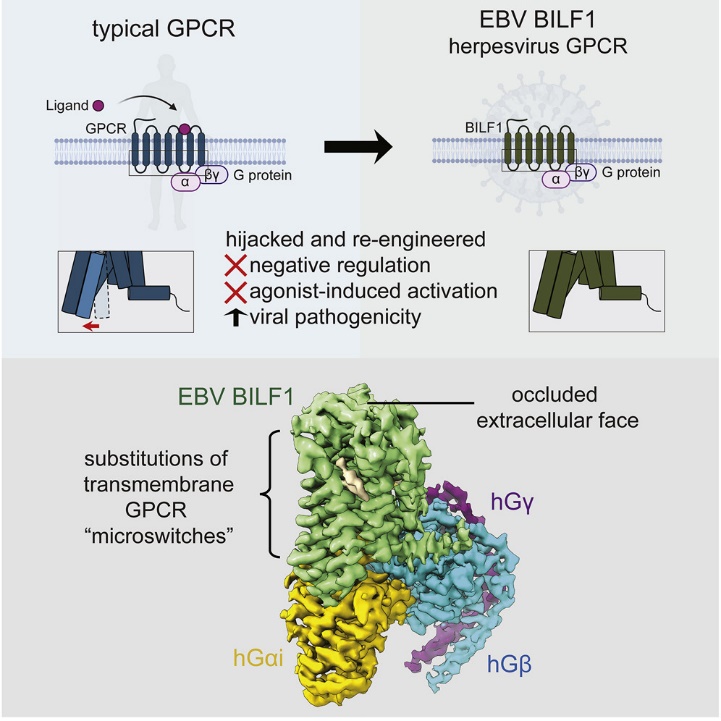
大部分GPCR受体都被其相应的内源性配体激活从而传递信号,然而EB病毒编码的BILF1目前并无配体得以鉴定,且能持续激活下游抑制型G蛋白,降低宿主细胞内cAMP含量。利用单颗粒冷冻电镜分析,BILF1蛋白演化出了一套特有的自激活构象开关 “microswitches“,与已知的激活状态下GPCR受体关键位点构象相似。这种不依赖于底物的持续自激活构象可能帮助EB病毒逃逸免疫监测。此项工作Structural basis for the constitutive activity and immunomodulatory properties of the Epstein-Barr virus-encoded G protein-coupled receptor BILF1于2021年7月2号在线发表于Immunity杂志。
相关论文信息:https://doi.org/10.1016/j.immuni.2021.06.001