Nature Communications丨屈前辉课题组与合作者报道GPI-AP生物合成与质量控制关键脂质重塑酶的分子机制
糖基磷脂酰肌醇(GPI)是真核生物中广泛存在的翻译后修饰。在哺乳动物细胞中,GPI-APs主要定位在细胞膜的脂筏上并在细胞信号转导、细胞黏附、催化等方面发挥重要作用,其合成缺陷导致严重的先天性神经发育紊乱。GPI-APs途径包括合成与重塑两个阶段,涉及20多步膜内催化反应。为阐明这一重要的翻译后修饰生物发生过程的分子机制,并助力特异性靶向该途径进行药物研发,中科院分子细胞科学卓越创新中心(上海生化细胞所)李典范课题组与复旦大学生物医学研究院/附属口腔医院屈前辉课题组通力合作,前期解析了合成阶段的关键酶复合物GPI-T的结构并揭示了其识别底物和催化的生化机制。
2024年1月2日,李典范课题组和屈前辉课题组在Nature Communications上合作再次发表题为 Molecular basis of the inositol deacylase PGAP1 involved in quality control of GPI-AP biogenesis的研究成果,通过冷冻电镜单颗粒技术解析了脂质重塑酶PGAP1在脂环境及与产物复合物的高分辨率结构(2.66-2.84 Å),揭示了PGAP1介导糖基磷脂酰肌醇锚定蛋白(GPI-AP)脂质重塑过程的分子机制。
PGAP1催化GPI-APs上的肌醇脱酰化(图1a),该脂质重塑反应开启GPI-APs的质量控制与囊泡运输等过程,因此是GPI-APs内质网分选及外运的检查点。PGAP1的活性丧失会引起人类发育相关疾病,引起动物不育或者致死。
因为GPI-APs的糖脂部分成分复杂,此前整个生物合成途径不存在酶动力学报道。研究团队设计了一种基于荧光的新型、简便、灵敏的生化分析方法(图 1b),对其酶学性质进行了表征,并采用哺乳细胞与酵母细胞水平的活性体系对其功能进行了鉴定。继而通过细胞工程方法,捕捉PGAP1与GPI锚定蛋白的复合物,并采用冷冻电镜手段,揭示了其由一个10次跨膜结构域、一个脂酶结构域与两个瑞士卷结构域组成的“活动扳手”状空间结构(图1c-e)。
目前已知的脂酶结构中,活性中心的入口存在一个调控底物结合的盖状螺旋。PGAP1具备该抑制性结构,而是采用一种新型机制实现催化保真性。PGAP1的底物GPI-AP脂肪链仅部分结合在跨膜区,其余部分被丰富的糖基“上拉”至膜外区。这种机制可防止PGAP1对膜脂的非特异水解。此外,研究团队还发现了PGAP1的几个非典型脂酶特征,并提出一个由胆固醇参与调控的底物-产物交换的工作模型。
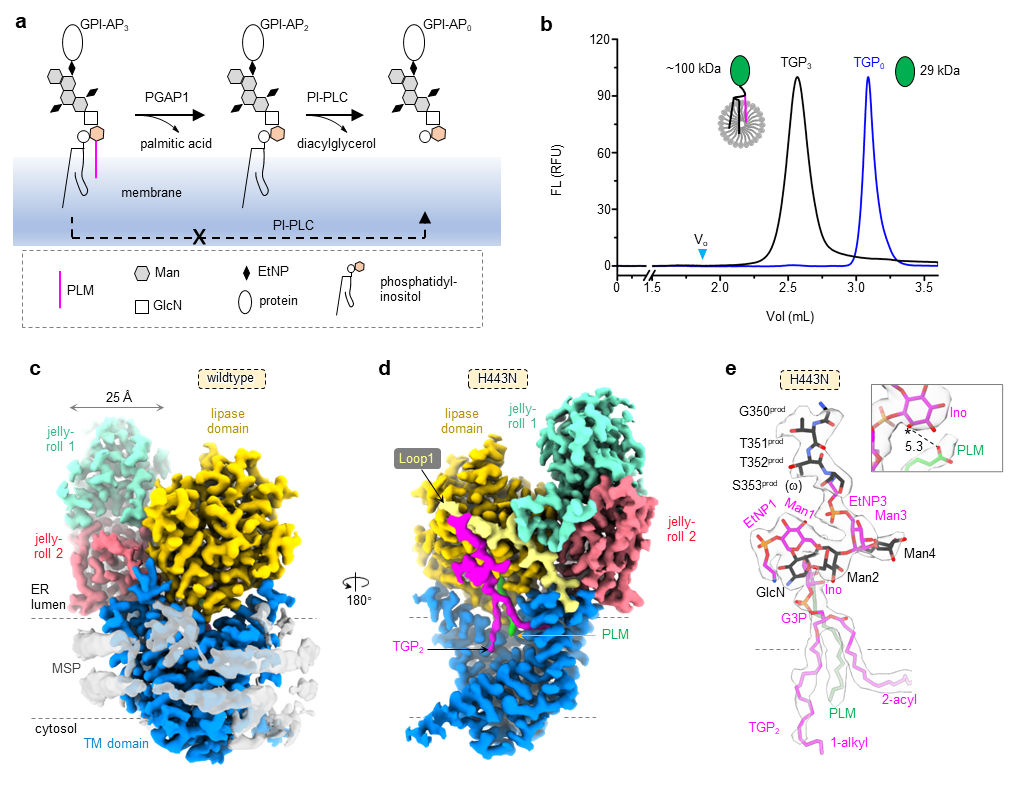
图1. PGAP1的结构与功能机制。a PGAP1的酶学反应及生化实验设计原理。b 本报道中设计的PGAP1生化实验原理与典型结果。c PGAP1的冷冻电镜密度图。d PGAP1突变体与产物结构的冷冻电镜密度图。e产物(GPI-AP与脂肪酸)结构和密度图。
该工作主要由中科院分子细胞科学卓越创新中心硕博连读研究生洪晶晶,博士后李婷婷,复旦大学生物医学研究院博士研究生晁钰琳等共同完成,徐乙丹博士、朱之妮同学、周子璇博士和顾维杰同学等做了重要贡献。中科院分子细胞科学卓越创新中心研究员李典范和复旦大学生物医学研究院/附属口腔医院青年研究员屈前辉为该论文的共同通讯作者。该研究得到国家自然基金委、科技部及中国科学院的资助。
原文链接:https://www.nature.com/articles/s41467-023-44568-2