Cell Research封面论文丨赵世民/徐薇合作团队揭示乳酰化响应缺氧预防运动损伤
史上最著名的过度运动损伤事件是古希腊通信兵Philippides, 为了将希腊军队在马拉松战役中的胜利消息尽快传递到雅典,连续奔跑42.195公里,在完成使命后因机能耗竭而死去。Philippides的死亡和后续经常发生的过度运动损伤案例提出了一个重要的科学问题:机体内是否存在过度运感知和对应的抑制系统?通过数个世纪的大量的研究人们提出各种假说,相关问题依然没有明确答案。
2024年1月2日,复旦大学赵世民课题组与复旦大学生物医学研究院徐薇课题组合作在Cell Research杂志发表题为“Hypoxia Induces Mitochondria Protein Lactylation to Limit Oxidative Phosphorylation”的封面论文,发现线粒体蛋白质乳酰化修饰被肌肉细胞低氧激活,表征运动程度,并通过抑制线粒体氧化磷酸化预防过度运动损伤。

他们发现,线粒体丙氨酰tRNA合成酶(AARS2)含有脯氨酸羟基化保守氨基酸序列,其稳定性在低氧条件下增强,激活的AARS2作为乳酰化转移酶,乳酰化线粒体丙酮酸脱氢酶催化亚基PDHA1和肉碱棕榈酰转移酶 2 (CPT2),抑制来自葡萄糖和脂肪酸的乙酰辅酶A生成和细胞呼吸。肌肉运动导致AARS2和乳酸上升,升高的肌肉乳酰化抑制ATP产出,进而抑制运动能力,确保肌肉不因不受控的过度运动发生过氧化合物风暴从而危及个体生命。
他们的发现在动物模型中得到验证,小鼠的持久运动能力与其线粒体乳酰化的遗传本底呈负相关,抑制PDHA1和CPT2的乳酰化修饰可以实现小鼠持久运动耐力提升。这一发现为运动员选材和激素非依赖途径提高运动水平提供了新思路。
该发现基于团队前期系列发现开展,2018年该团队在Cell Metabolism发表的题为“Sensing and Transmitting Intracellular Amino Acid Signals through Reversible Lysine Aminoacylations”封面文章的Figure 1原创发现:包括乳酸在内的众多代谢物可以修饰蛋白质(1)(图1)。
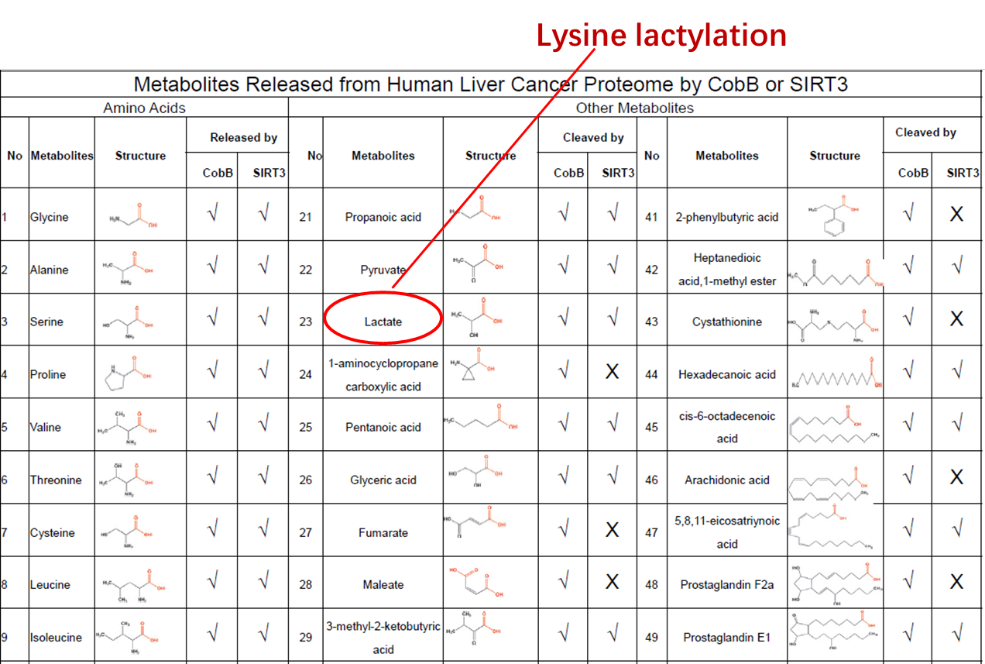
图1,团队2018年在Cell Metabolism杂志首次报道乳酸可以修饰蛋白质赖氨酸。
2019年其它团队在Nature发表的后续研究发现乳酸修饰以调控免疫(2),确认了乳酸修饰的生理意义。然而,横亘在乳酸修饰研究领域的一大障碍是未能确认高效特异的乳酰转移酶,以及对应的上游信号。团队前期发现,tRNA合成酶可与其对应氨基酸结构类似的代谢物相结合,促进代谢物的蛋白质修饰。比如,蛋氨酸tRNA合成酶MARS可以和与蛋氨酸结构类似的代谢物同型半胱氨酸相结合,催化同型半胱氨酸修饰蛋白质上的赖氨酸(3)。他们还发现,tRNA合成酶可以将氨基酸转化为含有羰基磷酸键的高能中间态分子,进而修饰蛋白质氨基酸(1)。研究者注意到,乳酸与丙氨酸化学结构非常类似,推测乳酸可能被丙氨酰tRNA合成酶活化并转移到蛋白质赖氨酸。这一推论在体外实验获得了证实(图2)。
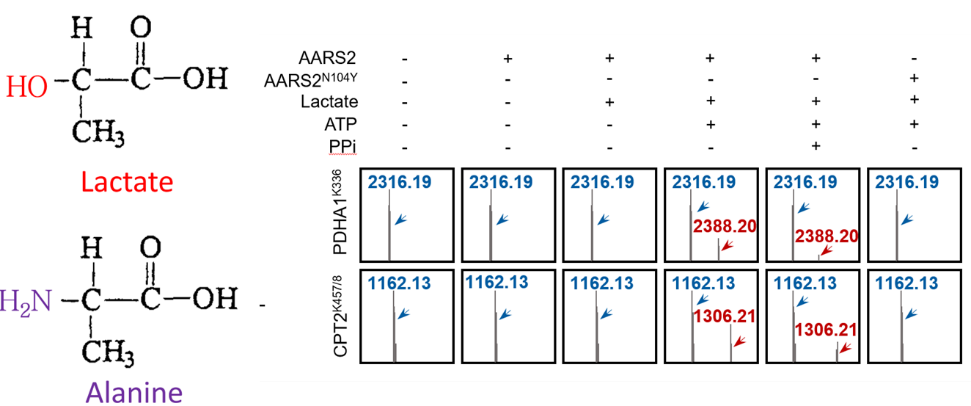
图2,乳酸作为丙氨酸结构类似物(左),可以被丙氨酰tRNA合成酶识别并修饰赖氨酸(右)。
线粒体里的AARS2具有乳酰转移酶活性,这一活性是否具有生理重要性呢?细胞内有两个丙氨酰tRNA合成酶同工酶,在胞质中发挥作用的AARS1和在线粒体内发挥作用的AARS2。研究者注意到,只有AARS2含有一个氧气响应原件,也就是一个能够被脯氨酸羟基化酶修饰的保守序列LXXLAP,而该序列在AARS1中不存在。而线粒体是细胞内氧化磷酸化和合成ATP的场所,这些过程需要消耗氧气,提示线粒体乳酰化修饰可能是机体感知细胞内氧气水平从而调控氧化磷酸化和ATP产出的分子基础。
研究者首先发现,细胞中AARS2的过表达能够显著抑制细胞的耗氧率(OCR),并降低乙酰辅酶A(Ac-CoA)水平,而敲除AARS2则具有相反的效应。Ac-CoA作为氧化磷酸化起始原料,具有两大主要来源:糖酵解来源的丙酮酸氧化脱羧和脂肪酸β氧化。前者由丙酮酸脱氢酶复合体PDC介导,后者系通过肉毒碱棕榈酰基转移酶CPT1/2将脂肪酸运送进线粒体。他们发现,AARS2可以乳酰化PDC复合体催化亚基PDHA1和线粒体内侧的肉毒碱棕榈酰基转移酶CPT2,并抑制两者的酶活,进而限制Ac-CoA生成,降低肌肉细胞氧化磷酸化和ATP产出,而氨基酸氧化途径并不受AARS2和乳酰化的调控(图2)。
研究者进而发现,AARS2的水平受到脯氨酸羟基化调控。与厌氧诱导因子HIF蛋白水平被脯氨酸羟基化促进降解类似,AARS2脯氨酸377的羟基化导致AARS2蛋白的降解。因此,低氧导致AARS2蛋白的稳定,也通过升高乳酰化抑制氧化磷酸化的进行(图3)。
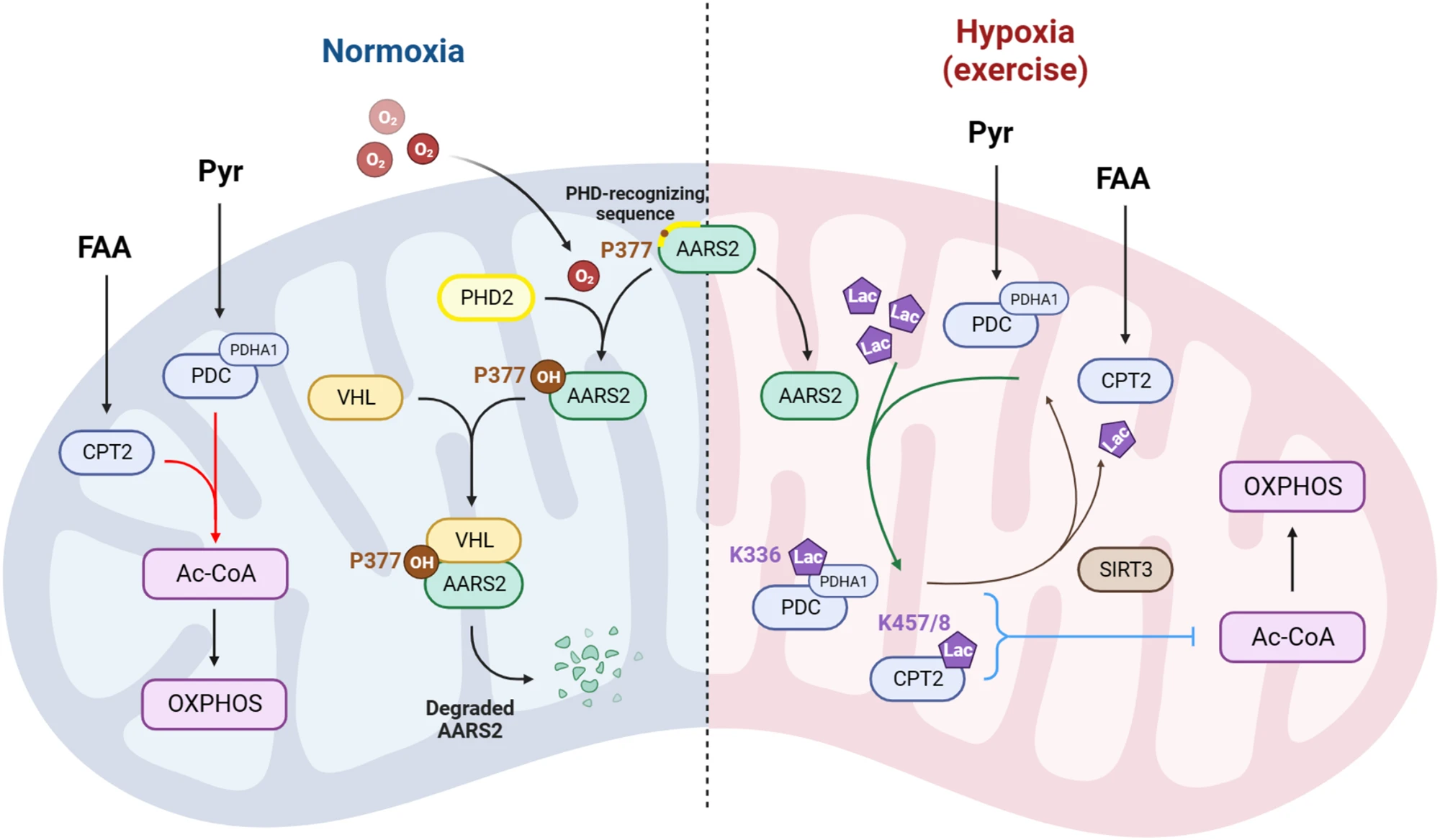
图3 低氧诱导AARS2减少糖酵解和脂肪酸氧化来源的Ac-CoA并抑制氧化磷酸化(图来自于同期专家评述,见下)
研究人员最后阐释了线粒体蛋白乳酰化修饰的运动医学意义。在持续运动过程中,增加的氧化磷酸化需要大量的氧气,乳酸被累积,同时,肌肉细胞通过氧化磷酸化以乳酸为能量来源以获得运动所需的ATP5这使得肌肉细胞对于氧气和乳酸水平都特别敏感。氧气水平的降低导致AARS2升高,乳酸在不能被氧化时迅速升高,这两个因素都通过升高线粒体乳酰化而抑制氧化磷酸化和肌肉ATP产出,进而抑制运动能力,并预防如活性氧ROS的累积,实施对过度耗竭运动损伤的保护(图4)。

图4 Cell Research封面: 乳酰化修饰预防过度运动损伤
有趣的是,研究人员发现,小鼠持续运动能力与其肌肉AARS2水平负相关,与SIRT3水平正相关。肌肉特异性AARS2过表达和SIRT3敲除小鼠持续运动能力降低,而AARS2敲除小鼠持续运动能力增强。这表明运动能力与基因决定的乳酰化修饰水平负相关,为耐力型运动员的选材提供了一个基因维度。他们给小鼠肌肉注射乳酸/丙氨酸类似物——β-丙氨酸(β-alanine),发现其能够通过竞争结合AARS2,抑制乳酰化修饰水平,有效提高小鼠的运动耐力。肌肉的β-alanine水平在运动过程中升高,说明其可以增强运动能力。虽然降低乳酰化修饰可以增强运动耐力,但考虑到其随之提升的氧化损伤水平,这并不是一种值得广泛提倡的改善运动能力的手段。
该机制的发现再一次证明了生命机器进化的精妙。在持续运动过程中,糖代谢物通过热力学驱动累积大量乳酸,而肌肉细胞通过耗氧的三羧酸循环氧化乳酸以获得运动所需的大量ATP(5)。在运动全过程中,乳酸水平和线粒体氧气水平对运动最为敏感。肌肉细胞通过乳酰化同时敏锐感知这两个运动相关指标,并通过控制ATP的生成来控制运动强度,保护肌体免于过度运动损伤。此外,乳酰化抑制能量代谢,提示乳酰化修饰在胚胎发育和肿瘤发生发展等高乳酸生理病理过程中的重要作用。 Cell Research杂志同期发表了题为“Lactylation constrains OXPHOS under hypoxia”的Research Highlight (https://www.nature.com/articles/s41422-023-00872-6)认为,该项研究强调了蛋白质乳酰化修饰在调控线粒体氧化磷酸化中的关键作用,以及乳酸等代谢物通过反馈机制调节细胞功能的重要性,即细胞如何通过代谢调节适应低氧,以减少ROS的产生和氧化损伤。此外,研究不仅揭示了AARS2作为乳酰基转移酶的全新功能,也为探索新型乳酰基转移酶开辟了途径。曾经被视为“代谢废物”的物质确实发挥着至关重要的作用。
复旦大学附属妇产科医院/代谢与整合生物学研究院赵世民教授、复旦大学生物医学研究院/附属第五医院徐薇教授为论文共同通讯作者,复旦大学附属妇产科医院博士后毛云子、张娇娇、周倩、何吓俤为共同第一作者。来自复旦大学、哈佛医学院、青海民族大学的研究人员共同参与了该项研究。项目获得科技部“发育编程的代谢调控”重点专项和国家自然科学基金委“生物大分子修饰与化学干预”重大研究计划等多项基金资助。
原文链接:https://www.nature.com/articles/s41422-023-00864-6#citeas
参考文献
1 He, X. D. et al. Sensing and Transmitting Intracellular Amino Acid Signals through Reversible Lysine Aminoacylations. Cell Metab, doi:10.1016/j.cmet.2017.10.015 (2017).
2 Zhang, D. et al. Metabolic regulation of gene expression by histone lactylation. Nature 574, 575-580, doi:10.1038/s41586-019-1678-1 (2019).
3 Mei, X. Y. et al. Inhibiting MARSs reduces hyperhomocysteinemia-associated neural tube and congenital heart defects. EMBO Molecular Medicine12 (2020).
4 Ivan, M. et al. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science 292, 464-468, doi:10.1126/science.1059817 (2001).
5 Brooks, G. A. The Science and Translation of Lactate Shuttle Theory. Cell Metabolism 27, 757-785, doi:10.1016/j.cmet.2018.03.008 (2018).