Cell Research丨屈前辉课题组与合作者报道囊泡单胺转运体VMAT2识别底物及被药物分子抑制的分子机制
血清素 (5-HT)、多巴胺 (DA) 和去甲肾上腺素 (NE) 是主要的单胺神经递质,在多种生理、情绪和行为功能中发挥着关键作用。单胺能神经传递失调与多种神经和精神疾病的发病机制有关,例如情感障碍、抑郁症、亨廷顿病、帕金森病(PD)、阿尔茨海默病(AD)、注意力缺陷多动障碍(ADHD)、自闭症谱系障碍(ASD)和精神分裂症。 尽管它们的生物合成途径不同,这些单胺物质都可以通过跨囊泡膜的质子梯度驱动的 VMAT2 转运蛋白的作用富集于突触前囊泡中。 此外,VMAT2 还可以保护神经元免受 MPP+等毒物的侵害。VMAT2 缺失的纯合小鼠表现出胚胎致死,而条件性基因敲除小鼠则表现出发育不良,以及与运动、焦虑、动机和对安非他明等药物的反应相关的行为变化的不同缺陷。此外,一些错义 VMAT2 变体与一种罕见的婴儿期运动障碍有关。
哺乳动物中主要存在两种单胺转运蛋白VMAT2和VMAT1(也分别称为 SLC18A2 和 SLC18A1),属于Major Facilitator Superfamily。 尽管两者序列相似性超过 60%,但这两种 VMAT 在细胞分布、底物识别和药理学特征方面存在显著差异。VMAT1 主要存在于交感神经和周围神经系统的神经内分泌细胞中,而 VMAT2 更广泛地分布在中枢和周围神经系统中。此外,VMAT2 与 VMAT1 可共存于肾上腺体,且其表达可被压力胁迫诱导,而 VMAT1 水平则相对保持恒定。VMAT2 和 VMAT1 对血清素的亲和力相似,但 VMAT2 对儿茶酚胺(例如 DA、NE、肾上腺素)的亲和力高出 3 倍,对组胺的亲和力更是高出 30 倍。 虽然竞争性抑制剂利血平 (reserpine,RES) 和酮舍林(ketanserin)对 VMAT2 的偏好程度仅略高于 VMAT1,但非竞争性抑制剂丁苯那嗪 (tetrabenazine,TBZ) 及其衍生物选择性地靶向 VMAT2。然而,VMAT2如何识别不同化学结构的单胺类底物,以及如何被不同药物分子作用的分子机制尚不清楚。
2024年1月2日,复旦大学生物医学研究院/附属口腔医院的屈前辉课题组与中科院分子细胞科学卓越创新中心(上海生化与细胞所)的汪胜课题组合作,在Cell Research上发表了题为Transport and inhibition mechanism for VMAT2-mediated synaptic vesicle loading of monoamines 的研究成果,揭示了囊泡单胺转运体VMAT2识别底物血清素5-HT的结构基础及被药物分子TBZ和RES所抑制的不同分子机制。在同期杂志上,南加州大学Cornelius Gati教授也撰写了Research Highlight对本研究工作进行了高度评价。


图1. VMAT2与底物5-HT、抑制剂TBZ和RES结合的冷冻电镜结构。a, Apo VAMT2朝向囊泡侧开口状态。b,底物5-HT结合囊泡侧口袋。c,非竞争性抑制剂TBZ引发VMAT2构象变化形成闭合状态。d,竞争性抑制剂RES结合胞质侧口袋。
由于VMAT2蛋白分子量小于60 kDa且缺乏稳定膜外结构域,作者采用了一种新型的融合蛋白策略以帮助冷冻电镜结构解析。简单来讲,在VMAT2的C端刚性Proline氨基酸处进行截断,融合一段长为12个氨基酸的ALFA螺旋小肽,并加入其皮摩尔级高亲和力的纳米抗体NbALFA,成功获得了VMAT2处于lumen-facing构象的VMAT2 apo状态结构VMAT2A,与底物血清素结合处于lumen-facing的VMAT2S,与非竞争性抑制剂TBZ结合的occluded状态VMAT2T,以及与竞争性抑制剂RES结合的cytosol-facing状态VMAT2YCR等复合物结构(图1)。
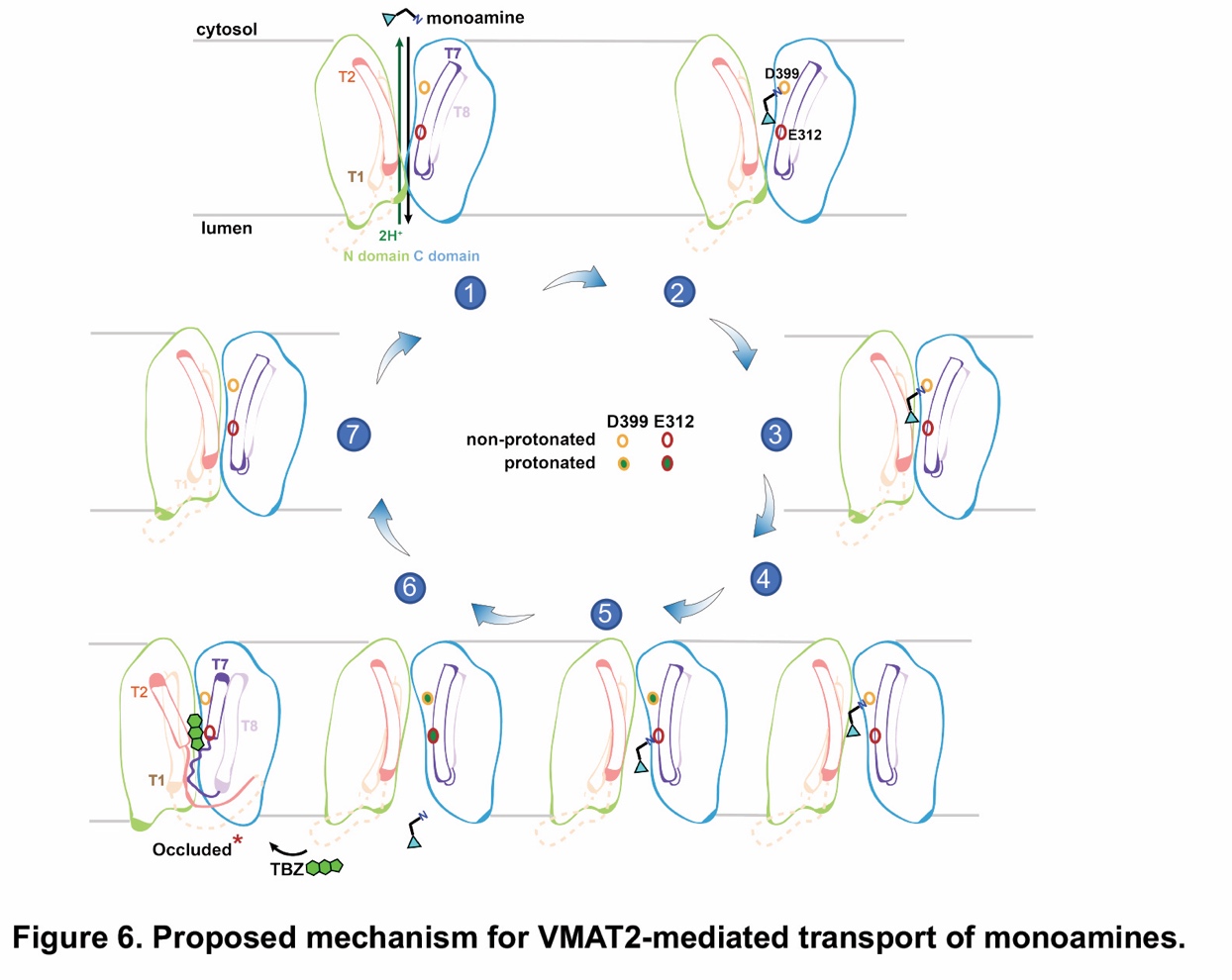
图2. VMAT2转运单胺类底物的工作模型。
通过综合使用生化细胞实验和分子对接及动态模拟等手段,作者提出了VMAT2采用经典的alternating access方式转运底物的工作模型(图2),尤其是两个重要的酸性氨基酸D399和E312,可能依次发生质子化而促进单胺分子运输。该研究有助于阐释质子梯度驱动VMAT2进行工作的基本原理,并为靶向VMAT2的药物研发提供重要的理论基础。
值得注意的是,同时期Nature杂志分别发表了美国圣裘德儿童研究医院李佳学与北京大学生命科学学院张哲团队合作的Mechanisms of neurotransmitter transport and drug inhibition in human VAMT2 ,以及中科院物理研究所姜道华与中科院生物物理所赵岩团队合作的Transport and inhibition mechanisms of human VMAT2研究工作。
该工作主要由复旦大学生物医学研究院博士研究生王雨薇,中科院分子细胞科学卓越创新中心博士研究生张沛,复旦大学生物医学研究院博士研究生晁钰琳、杨传辉,研究助理朱之妮及附属口腔医院博士后周子璇等共同完成,复旦大学生物医学研究院博士后李尧慧和博士研究生龙永惠同学也做了重要贡献。该研究工作还得到了复旦大学附属口腔医院刘月华教授、中科院分子细胞科学卓越创新中心研究员李典范和复旦大学附属眼耳鼻喉科医院舒易来教授的大力支持,以及复旦大学冷冻电镜平台老师的帮助。复旦大学生物医学研究院/附属口腔医院青年研究员屈前辉和中科院分子细胞科学卓越创新中心研究员汪胜为该论文的共同通讯作者。该研究得到了国家自然基金委和科技部的经费资助。
原文链接:https://www.nature.com/articles/s41422-023-00906-z#citeas