Sci Adv丨余发星课题组于合作者揭示TERT诱导甲状腺癌去分化机制及靶向策略
染色体端粒长度同肿瘤发生发展密切相关。在健康人的大多数体细胞中,端粒酶逆转录酶(Telomerase Reverse Transcriptase, TERT)表达沉默,因此检测不出端粒酶活性。然而,TERT表达及端粒酶活性在90%恶性肿瘤中被重新激活(TERT reactivation)。其中,TERT启动子突变是TERT激活的主要形式,在甲状腺癌、脑胶质瘤、尿路上皮肿瘤、黑色素瘤、肝癌等多种恶性肿瘤中高频发生,且与不良预后相关。尤其在甲状腺癌中,随着甲状腺癌分化程度的降低,TERT启动子突变频率明显增高(突变率在甲状腺乳头状癌、低分化癌及未分化癌中分别约为10%、40%及70%),提示TERT在肿瘤去分化及恶化过程中发挥重要作用。靶向TERT的药物由于往往导致骨髓抑制、心血管损伤等严重不良反应,目前尚无进入临床阶段的有效药物。因此,TERT重新激活的致癌机制是肿瘤学研究的共性科学问题,明确相关机制、开发可替代靶向TERT的有效治疗策略具有重大临床转化意义。
2023年8月30日,复旦大学附属肿瘤医院头颈外科王玉龙课题组与复旦大学生物医学研究院\复旦大学附属儿科医院余发星课题组合作,于Science Advances在线发表题为TERT accelerates BRAF mutant-induced thyroid cancer dedifferentiation and progression by regulating ribosome biogenesis的研究论文。该研究构建了高度模拟人类不同分化程度甲状腺癌临床特征的遗传小鼠模型,基于空间转录组鉴定出TERT通过核糖体生物合成途径(非经典端粒酶逆转录酶活性)促进肿瘤进展的机制,并发现靶向核糖体RNA转录可以有效抑制甲状腺肿瘤生长、并增强TERT激活型甲状腺癌的碘摄取能力,为TERT重新激活癌种及碘治疗抵抗的TERT激活型甲状腺癌患者的治疗提供了候选策略。

该研究首先分析了多个大规模泛癌数据库和自有测序数据,聚焦于甲状腺癌中BRAF/TERT启动子共突变的群体(甲状腺癌中预后更差,更易复发的群体)。研究者构建了条件性TERT过表达转基因鼠,通过与BRAF V600E和Tpo-CreERT2小鼠交配得到了甲状腺滤泡上皮细胞特异性BRAF V600E突变和/或TERT过表达小鼠,并使用小动物超声进行为期18个月的定期监测。研究者发现,甲状腺滤泡上皮单纯激活BRAF V600E可诱导甲状腺乳头状癌,单纯过表达TERT不会驱动肿瘤形成,但二者联合会诱导小鼠甲状腺肿瘤在8月龄突然变大、出现低分化癌、并伴有肺转移。
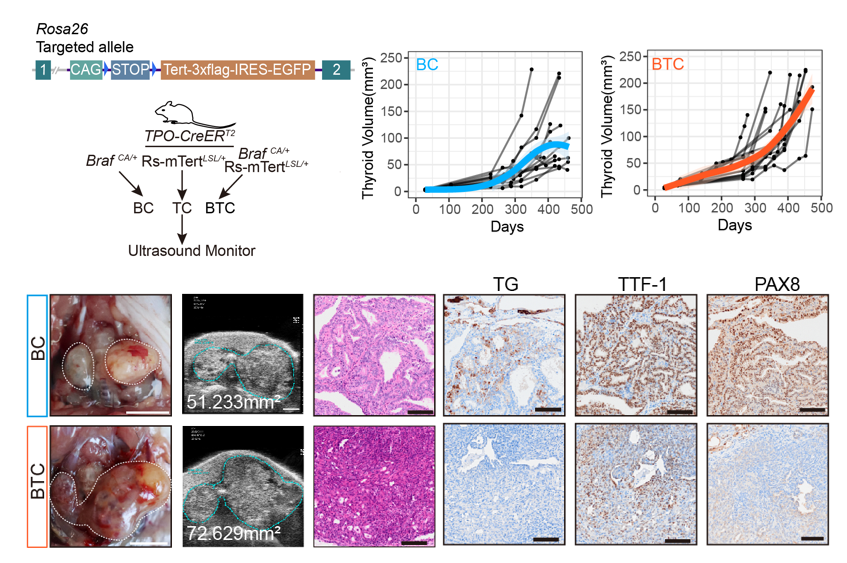
为了明确TERT促进甲状腺癌去分化的机制,研究人员对12月龄的BRAF/TERT小鼠甲状腺进行了空间转录组测序,发现其甲状腺内部具有高度的异质性,既有高表达Tg,Tpo等经典甲状腺分化标记物的细胞,也有乳头状癌及低分化癌细胞。拟时序分析和通路富集分析显示,随着端粒酶活性的升高,甲状腺分化评分逐渐降低,同时伴随着核糖体相关通路的激活。研究者通过多种数据分析及实验,发现TERT调节核糖体RNA(rRNA)的表达以及蛋白质翻译,从而驱动甲状腺癌逐步去分化。
由于直接靶向TERT或者端粒酶的治疗往往副反应较大,研究人员探索了是否可以通过靶向核糖体RNA转录来代替靶向端粒酶。令人惊喜的是,核糖体RNA转录抑制剂CX-5461,不仅可以有效抑制TERT激活型甲状腺癌的进展,还可以诱导甲状腺癌的再分化,使甲状腺癌的放射性碘摄取能力明显增强,为TERT激活型肿瘤和碘抵抗甲状腺癌的靶向治疗提供了潜在方案。
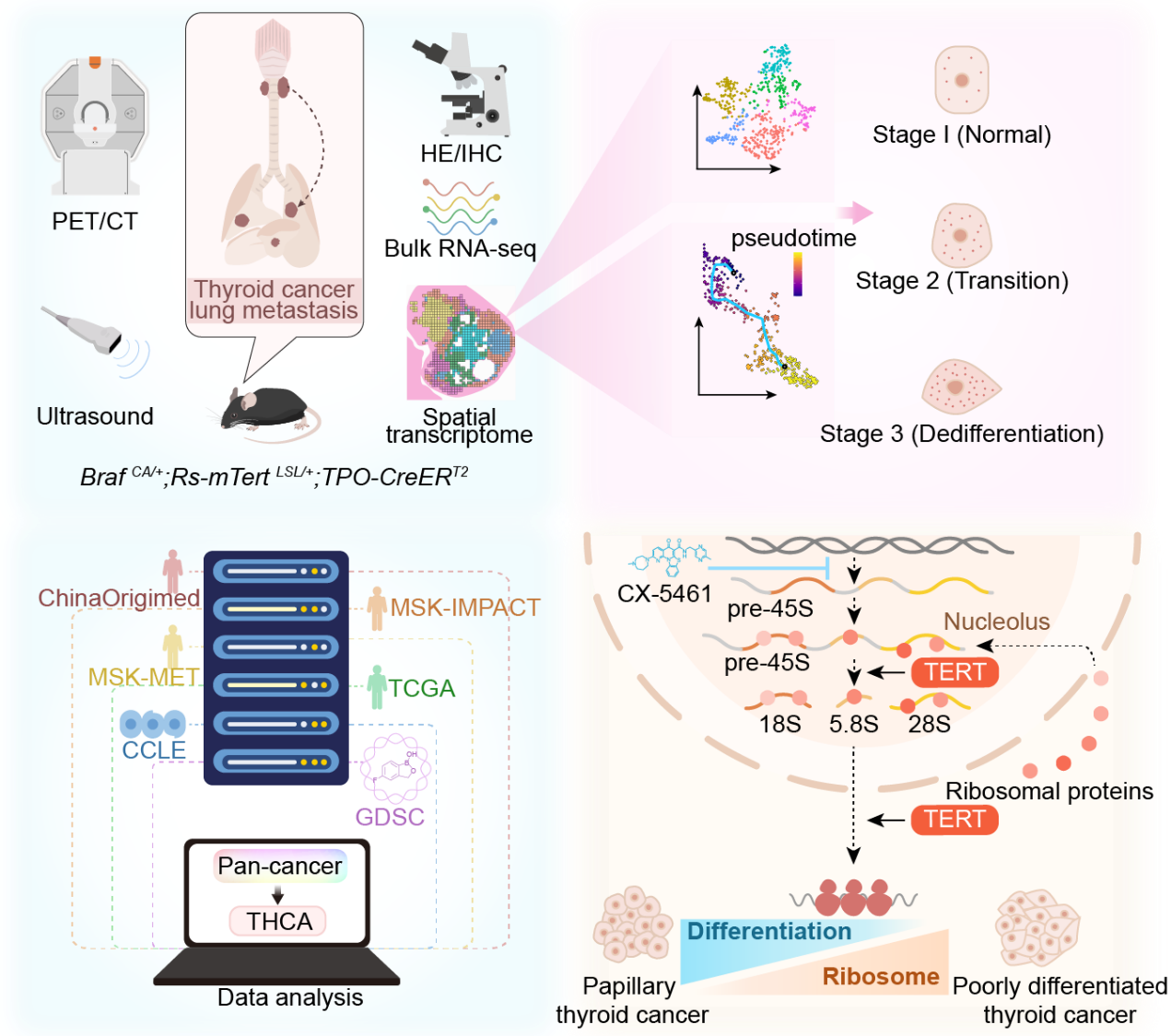
综上所述,该研究揭示了TERT通过调控核糖体生物合成促进BRAF突变甲状腺癌的演进和去分化的分子机制,并提出核糖体RNA抑制剂既可抑制肿瘤生长,又可诱导肿瘤再分化,为TERT激活型肿瘤和碘抵抗型甲状腺癌提供了靶向治疗新策略。
复旦大学附属肿瘤医院头颈外科博士研究生于鹏程、渠宁医师,复旦大学附属儿科医院/复旦大学生物医学研究院助理研究员朱锐,复旦大学附属肿瘤医院头颈外科胡佳倩医师为本文的共同第一作者。复旦大学附属肿瘤医院头颈外科王玉龙主任医师、复旦大学生物医学研究院/附属儿科医院余发星研究员为本文的共同通讯作者。复旦大学生物医学研究院蓝斐课题组、复旦大学附属肿瘤医院核医学科宋少莉课题组提供了重要支持。
原文链接:https://www.science.org/doi/10.1126/sciadv.adg7125