许杰团队在《Oncogene》发表综述阐述免疫检查点蛋白靶向降解在抗肿瘤药物发现中的作用
近年来PD-1抗体等免疫检查点阻断疗法在部分肿瘤中显示显著的疗效,然而低应答率、获得性耐药和免疫相关不良反应等问题的存在仍然限制着免疫检查点阻断疗法的临床效果。
近日,复旦大学生物医学研究院许杰课题组在Oncogene杂志发表题为“Targeted degradation of immune checkpoint proteins: emerging strategies for cancer immunotherapy”的综述论文,系统地阐述了通过靶向降解方法进行免疫检查点抑制剂药物先导化合物发现的新策略。

虽然现有的抗体药物具有体内半衰期长等优势,但可能结合正常细胞表面的靶蛋白从而引免疫相关副作用。由于抗体分子无法透过细胞膜,PD-1/PD-L1等胞内区具有的促癌功能并不能通过抗体进行阻断。肿瘤细胞内储存的PD-1还可能补充被抗体中和的蛋白从而产生耐药。因此,亟待开发具有不同作用机制的新型免疫检查点抑制剂。
作为药物发现的一种创新方法,靶向降解(Targeted degradation)利用细胞的泛素-蛋白酶体系统、内体-溶酶体系统特异性地降解靶蛋白,从而实现对靶点功能更全面与持续的干预。在这篇综述论文中,许杰与国内外合作者从多个方面阐述了免疫检查点蛋白靶向降解的策略,包括蛋白质水解靶向嵌合体(Proteolysis Targeting Chimera, PROTAC)、溶酶体靶向嵌合体(Lysosome-Targeting Chimaera, LYTAC/LYSOTAC)、选择性自噬(Selective Autophagy)、分子伴侣蛋白介导的自噬(CMA,chaperone-mediated autophagy)等,论文中的图1对上述靶向方式的作用机制进行了说明:
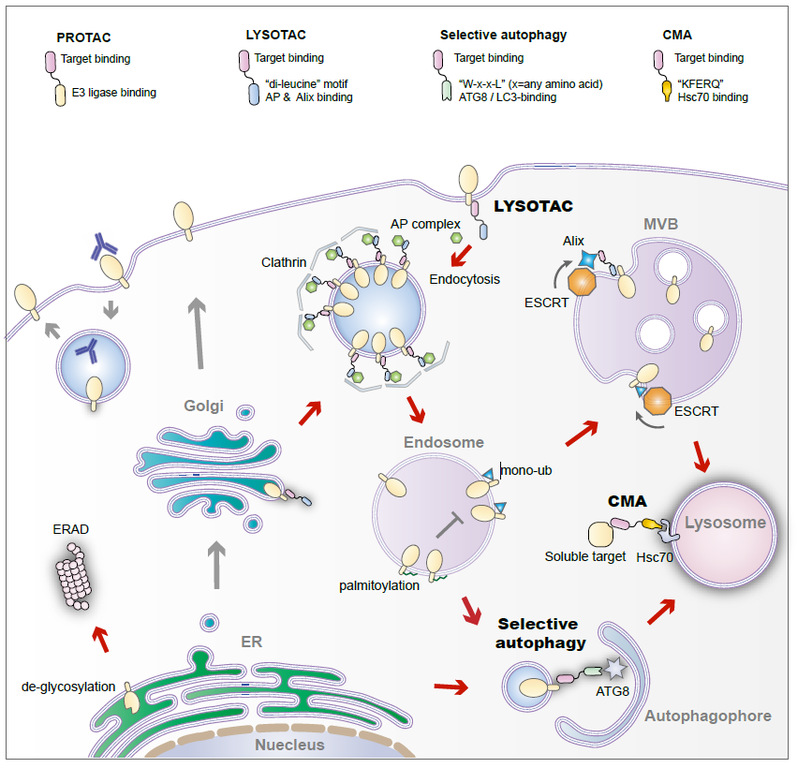
作者对已发现的PD-LYSO和PD-PALM等靶向降解分子及作用机制进行了讨论,也对今后的候选化合物筛选面临的问题和对策进行了阐述。
该论文的通讯作者是许杰研究员,共同作者包括加拿大Sherbrooke大学的Jean-Philippe Brosseau教授和四川大学生物治疗国家重点实验室的石虎兵教授。据悉,许杰课题组在该方向的研究近期获得了国家自然科学基金重点项目的资助,今后将开展多重靶向降解分子的发现等研究。上述研究得到了我院肿瘤免疫研究团队和表观遗传学重点实验室的支持。
原文链接:
https://www.nature.com/articles/s41388-020-01491-w