Nature丨陈飞团队揭示转录与基因组稳定性“双重质控”新机制
高等生物中,由RNA聚合酶II (Pol II)介导的转录是一个高度动态的过程,包括了转录起始、启动子近端暂停、延伸和终止等步骤。完成转录起始的Pol II会在转录起始位点 (TSSs) 下游200 bp的窗口内发生短暂暂停,并面临两种命运选择——走向有效延伸(productive elongation)或者在启动子附近发生转录早期终止(promoter-proximal premature termination)。其中,前者由蛋白激酶复合物P-TEFb调控,它能有效促进基因的转录激活;后者由包含磷酸酶活性的INTAC复合物调控,会导致该轮转录过程的提前结束。因此,转录机器在启动子区域的命运抉择,被认为是高等生物中基因转录调控的核心步骤之一,也是转录精准调控的关键质控环节。然而,相比于人们对P-TEFb介导的有效延伸的充分认知,INTAC介导转录早期终止的调控机制仍存在很多未解之谜(1,2)。
基因转录过程中产生的新生RNA(nascent RNA)可以与打开的双链DNA中的模板链发生碱基互补配对,形成RNA:DNA杂交链。RNA:DNA杂交链与未配对的单链DNA(single-strand DNA, ssDNA)所形成的三链核酸结构被称为R-loop。R-loops结构稳定,通常富集于Pol II发生较高水平暂停的启动子区域以及活跃表达的基因上。已有研究表明,R-loop的异常累积会对基因组稳定性造成重大威胁。一方面,R-loop中暴露的ssDNA极易受到诱变剂和核酸酶的攻击;另一方面,R-loop会阻碍复制叉前行,诱发转录与复制冲突。因此,R-loop水平的精准调控也是维持基因组稳定性的重要质控环节。然而,作为转录过程中广泛产生的副产物,人们对于基因转录机器如何调控R-loop水平和维持基因组稳定性的机制并不清楚(3,4)。
2023年8月9日,复旦大学生物医学研究院陈飞课题组与浙江大学陆华松课题组合作,在Nature期刊以长文形式发表了文章R-loop dependent promoter-proximal termination ensures genome stability(《R-loop依赖的启动子近端转录早期终止维持基因组稳定性》)。该研究首次发现了INTAC复合物与单链DNA识别复合物SOSS稳定结合并形成SOSS-INTAC复合物;该复合物以凝聚体的形式通过调控细胞内R-loop的水平维持基因组稳定性。

研究者在分析INTAC的蛋白互作质谱结果时发现,INTAC与一个单链DNA识别复合物SOSS(Sensor of Single-Strand DNA)存在非常强的相互作用。SOSS在之前的研究中被发现主要在DNA damage repair中起作用。研究者通过一系列体内外的生物化学以及基因组学等实验手段证明了SOSS-INTAC复合物在染色质上的稳定存在。
进一步的研究发现,SOSS-INTAC复合物主要结合在基因的启动子区域。SOSS中的ssDNA识别蛋白会诱导SOSS-INTAC与ssDNA结合,并促进SOSS-INTAC复合物在染色质上的招募及发挥转录早期终止的功能。机制研究表明,SOSS-INTAC在染色质上的结合依赖于R-loop结构中的ssDNA。识别R-loops之后,SOSS-INTAC通过其RNA核酸内切酶作用诱导转录早期终止,同时协同RNA核酸外切酶exosome和XRN2,防止R-loops的过度积累,从而实现维持基因组稳定性的功能。最后,研究者还发现SOSS-INTAC在细胞内以生物大分子凝聚体的形式存在,并且这种凝聚体被破坏后会显著影响SOSS-INTAC调控R-loops和基因组稳定性的能力。
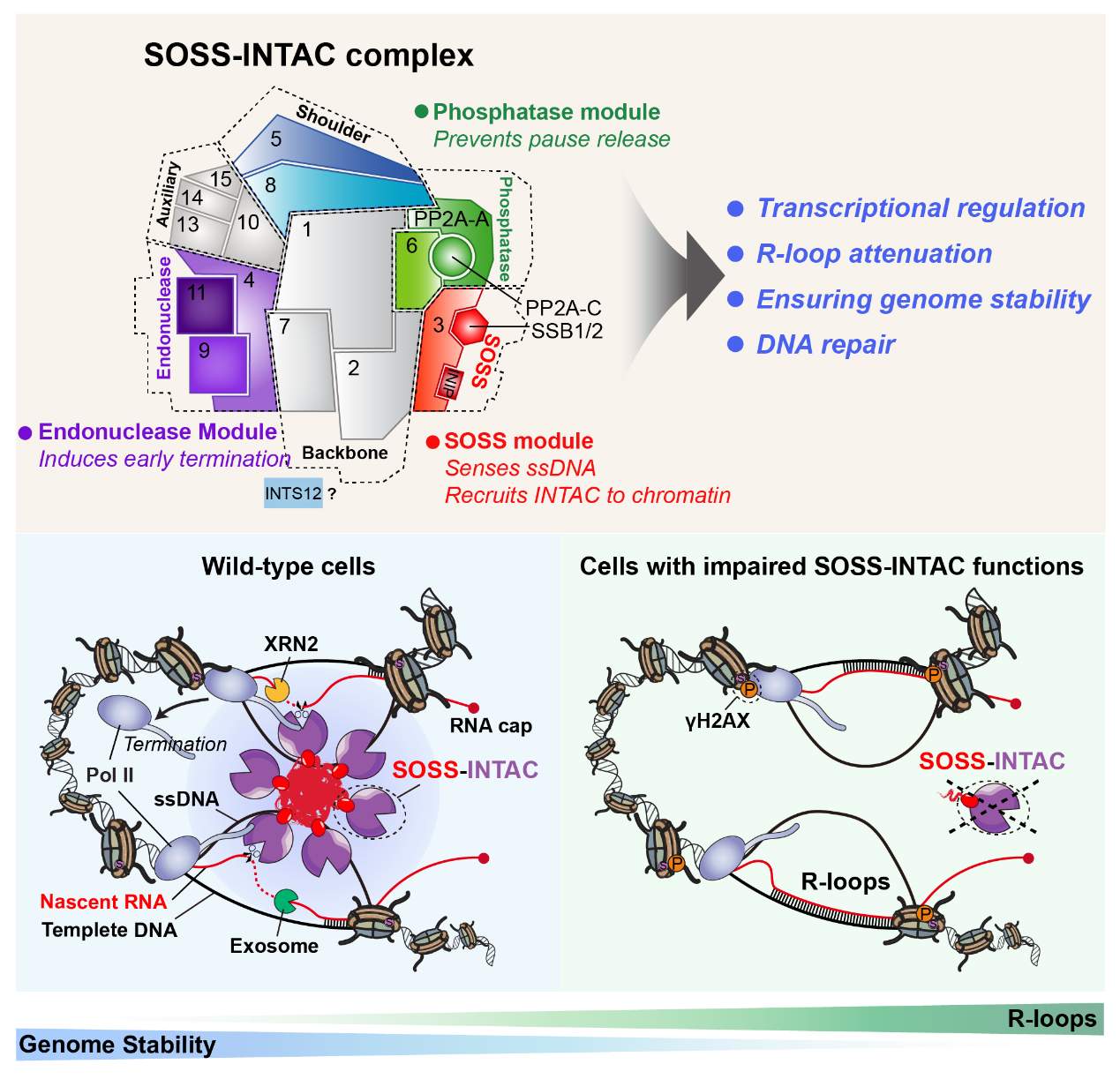
图注:SOSS-INTAC的工作模型。SOSS-INTAC通过SOSS所具有的ssDNA识别能力,以生物大分子凝聚体的形式通过识别转录过程产生的R-loop结构中的ssDNA将INTAC招募至染色质上,发挥基因转录早期终止的功能;SOSS-INTAC与RNA核酸外切酶exosome和XRN2协同,抑制染色质上R-loops过度积累,从而维持细胞内的基因组稳定性。
综上所述,该研究论文首次鉴定了一个基因转录和基因组稳定性调控复合物SOSS-INTAC,并揭示了其在基因转录调控和基因组稳定性维持中的“双重质控”功能,是基因转录与基因组稳定性交叉研究领域的又一突破性发现。
值得一提的是,自2020年发现INTAC复合物(Science,2020)以来,陈飞课题组首次报道了INTAC通过其磷酸酶底物SPT5调控转录进程的机制(Mol Cell,2021),并发现了转录延伸因子PAF1通过INTAC调控转录暂停和释放的方式(Sci Adv,2022)。近期,该团队进一步揭示了INTAC复合物的RNA核酸内切酶和磷酸酶两个功能模块在转录调控中扮演了不同的角色(Mol Cell,2023)。本项研究的发现,进一步把INTAC复合物及其介导的基因转录早期终止的功能拓展到了基因组稳定性调控的领域。
复旦大学附属肿瘤医院博士后徐从玲(即将入职同济大学生命科学与技术学院,独立PI),浙江大学生命科学研究院20级直博生李呈瑜,复旦大学生物医学研究院原博士后陈吉伟(现为复旦大学附属肿瘤医院助理研究员),复旦大学生物医学研究院21级直博生熊燕为本研究共同第一作者。复旦大学陈飞研究员和浙江大学陆华松研究员为共同通讯作者。
原文链接:https://www.nature.com/articles/s41586-023-06515-5
附:复旦大学陈飞课题组将依托复旦大学生物医学研究院和附属肿瘤医院,长期聚焦基因转录和表观遗传调控的机制研究及其在发育和癌症中的功能研究。自2020年初在复旦大学建立课题组后,以通讯作者在Nature (2023)、Science (2020)、Molecular Cell(2021, 2023)、Cell Research (2023)、Science Advances (2022)、Cell Reports (2022)等杂志发表论文。实验室详情见课题组主页:chenf-lab.fudan.edu.cn。目前课题组拟招聘博士后若干,长期欢迎志同道合、热爱科研的朋友加入。联系方式:feixchen@fudan.edu.cn
参考文献:
1 Chen, F. X., Smith, E. R. & Shilatifard, A. Born to run: control of transcription elongation by RNA polymerase II. Nat Rev Mol Cell Biol 19, 464-478, doi:10.1038/s41580-018-0010-5 (2018).
2 Core, L. & Adelman, K. Promoter-proximal pausing of RNA polymerase II: a nexus of gene regulation. Genes Dev 33, 960-982, doi:10.1101/gad.325142.119 (2019).
3 Crossley, M. P., Bocek, M. & Cimprich, K. A. R-Loops as Cellular Regulators and Genomic Threats. Mol Cell 73, 398-411, doi:10.1016/j.molcel.2019.01.024 (2019).
4 Petermann, E., Lan, L. & Zou, L. Sources, resolution and physiological relevance of R-loops and RNA-DNA hybrids. Nat Rev Mol Cell Biol 23, 521-540, doi:10.1038/s41580-022-00474-x (2022).