PNAS丨温文玉团队发现HECT型E3连接酶活性的相分离调控机制
泛素化是一种受到高度调控的蛋白质翻译后修饰,泛素激活酶E1-结合酶E2-连接酶E3的有序酶促反应催化单泛素分子或泛素链共价连接到底物蛋白,进而参与信号传导、蛋白酶体降解、细胞自噬、以及DNA损伤修复等一系列细胞活动(1)。E3介导将泛素由E2转移到底物的最后一步,因而决定了泛素化修饰的特异性。Nedd4家族 (Itch, Smurf1/2, WWP1/2, Nedd4/4L和NEDL1/2) 是人源HECT型E3最大的一个亚类,具有相似的结构组成:用于亚细胞定位的C2结构域、2-4个结合底物的WW结构域以及催化结构域HECT。静息状态下,Nedd4家族成员保持较低的酶活性从而避免非特异的泛素化修饰。
复旦大学生物医学研究院温文玉课题组近年来对Nedd4家族E3的活性调控机制开展了系统研究,阐明了Itch及其果蝇同源蛋白Su(dx)、以及WWP1的自抑制机制,提出了Nedd4家族活性的多锁调控模型。发现Nedd4家族E3相邻WW结构域之间的连接(linker),例如Nedd4/4L和Smurf2中的WW12连接,Itch、WWP1/2及Su(dx)中的WW23连接等,插入由HECT的两个裂片形成的凹槽中,以限制它们在E2-E3泛素转移过程中的转向,从而抑制泛素酶活性(2-4)。接头蛋白(如Ndfip1)通过多个PPxY基序协同结合Itch的多个WW,可以释放HECT以激活Itch,而异常激活的Itch会引起小鼠胚胎神经发育过程中大脑皮层神经元迁移缺陷(2)。WWP1很多肿瘤相关的突变位点恰好位于其酶活性调控界面上,这些突变会因为促进靶标蛋白的泛素化降解进而促进肿瘤细胞的增殖迁移(3) 。同期,约翰霍普金斯大学的Philip A. Cole课题组解析了WWP2的自抑制结构,其与Itch的自抑制结构高度相似,他们发现Linker的磷酸化可以破坏其与HECT的结合从而释放HECT,强调了基于Linker的激活机理(5)。这几项工作提示多位点抑酶机制可以使Nedd4 E3在结合不同激活因子/底物或经过翻译后修饰展现出不同的活性,从而更精确地调控其酶活性,使其在特定时空间行使功能。然而,这些基于晶体结构的静态信息无法解释高效酶促反应中的开关状行为。
2023年8月7日,温文玉课题组在PNAS杂志上发表了题为 “ Feedback regulation of ubiquitination and phase separation of HECT E3 ligases ” 的研究工作。该研究揭示了HECT型泛素连接酶通过液液相分离(LLPS)促进其长链泛素化活性的新机制,拓展了对HECT型E3活性调控的认知,也为HECT型E3酶活性失调相关疾病的干预提供了新的思路。

不同于前期对Nedd4家族酶活反应的研究,作者意外发现当Itch与含有一个PPAY 基序的接头蛋白Spartin共表达时形成细胞内凝聚体,体外重组酶活系统观察到Itch在催化反应后形成高度动态的液滴结构,这是液液相分离的典型特点。Itch凝聚体的形成强烈依赖于泛素化反应的发生,并且在凝聚体内富集泛素、Itch、激活蛋白Spartin以及E2等泛素化反应元件。通过体外泛素化实验对Itch酶活性和相分离现象的观察,作者发现Itch的泛素化反应可以分为两个阶段:(1)起始短链泛素合成阶段(Ub<4),几乎无长链泛素生成,也没有相分离现象;(2)Ub4及以上的长链泛素化产物呈开关状迅速产生,同时发生相分离现象。Itch的相分离和长链泛素化活性展示出完美的同步性,提示相分离依赖于长链泛素的产生。
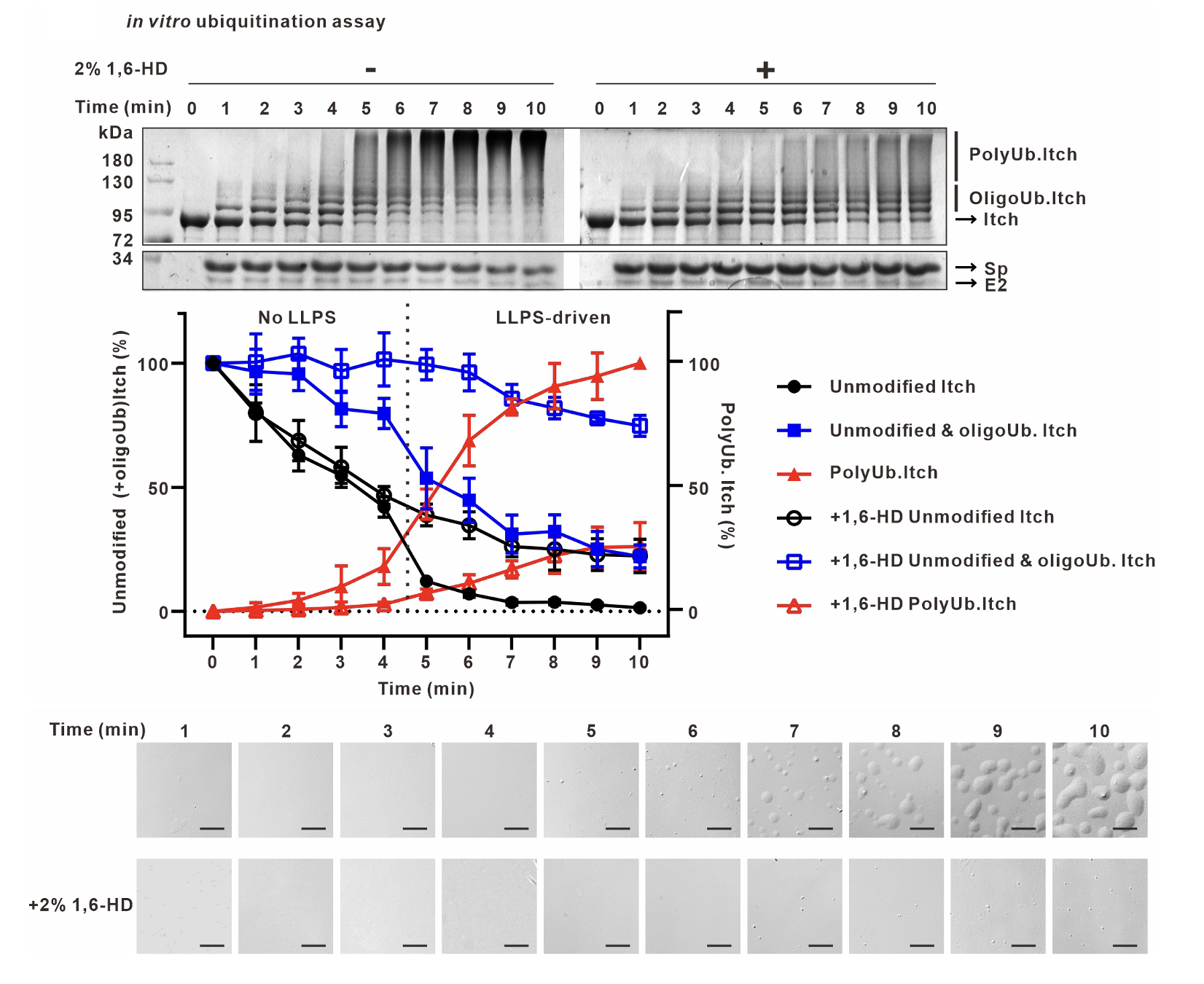
由于Itch催化的长链泛素生成不是匀速过程,而是前期慢后期快,且相分离凝聚了泛素化反应成分,作者推测相分离可以提高泛素化效率。作者随后利用相分离抑制剂1,6-HD的干扰、构建重组蛋白增强Itch的相分离、以及设计可诱导的相分离系统分别验证了抑制或增强相分离对Itch长链泛素化能力的影响,发现Itch的长链泛素催化效率与相分离能力之间的高度一致性,从而用严谨的生化手段证明了Itch相分离和长链泛素化活性之间相互依赖相互促进的正反馈关系。
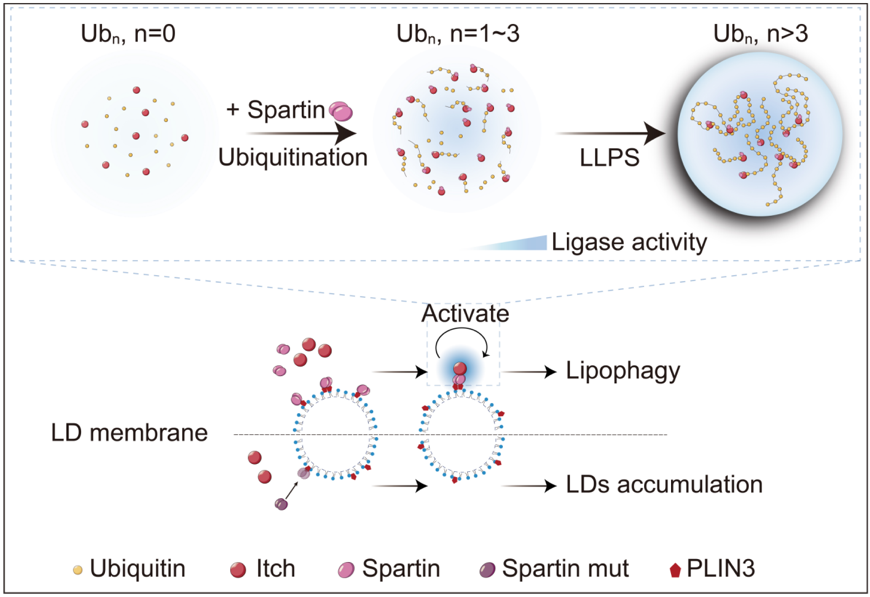
长链泛素是多种细胞活动的重要信号,例如蛋白酶体识别泛素化底物的最小单位是Ub4,长链泛素也更有利于重要自噬接头蛋白p62组装货物。该研究发现Itch的相分离由保守的HECT结构域和长链泛素之间的多价疏水相互作用驱动,Spartin并不直接参与相分离,而是通过结合Itch的WW释放HECT以激活Itch合成泛素链。HECT家族其他 E3的HECT同样具有该相分离性质,提示HECT家族可能具有普适的相分离介导的活性调控机制。
Spartin通过激活并招募Itch至脂滴表面催化脂滴表面蛋白的泛素化,进而促进泛素依赖性的脂滴自噬降解过程。其编码基因SPG20的单碱基缺失突变导致一种神经退行性疾病遗传性截瘫痉挛Troyer Syndrome,这种突变表达的截短体产物无法结合脂滴。该研究发现破坏Itch的相分离降低了Itch-Spartin对脂滴周转的调节能力,提出定位于脂滴表面的Itch-Spartin活性凝聚体在调节脂滴周转中发挥功能。
复旦大学温文玉研究员为本论文通讯作者,博士生李静宇和祝康博士(现为牛津大学病理系博士后)为并列第一作者,博士生顾爱红、黄仕敬和硕士生张怡晴也参与了部分工作。
原文链接: https://www.pnas.org/doi/10.1073/pnas.2302478120
参考文献:
Cruz Walma, D.A., Chen, Z., Bullock, A.N., and Yamada, K.M. (2022) Ubiquitin ligases: guardians of mammalian development. Nat Rev Mol Cell Biol, 23, 350-367.
Zhu, K., Shan, Z., Chen, X., Cai, Y., Cui, L., Yao, W., Wang, Z., Shi, P., Tian, C., Lou, J. et al. (2017) Allosteric auto-inhibition and activation of the Nedd4 family E3 ligase Itch. EMBO Rep, 18, 1618-1630.
Wang, Z., Liu, Z., Chen, X., Li, J., Yao, W., Huang, S., Gu, A., Lei, Q.Y., Mao, Y. and Wen, W. (2019) A multi-lock inhibitory mechanism for fine-tuning enzyme activities of the HECT family E3 ligases. Nat Commun, 10, 3162.
Yao, W., Shan, Z., Gu, A., Fu, M., Shi, Z. and Wen, W. (2018) WW domain-mediated regulation and activation of E3 ubiquitin ligase Suppressor of Deltex. J Biol Chem, 293, 16697-16708.
Chen, Z., Jiang, H., Xu, W., Li, X., Dempsey, D.R., Zhang, X., Devreotes, P., Wolberger, C., Amzel, L.M., Gabelli, S.B. et al. (2017) A Tunable Brake for HECT Ubiquitin Ligases. Mol Cell, 66, 345-357.