Immunity丨储以微/刘荣花团队聚焦B淋巴细胞揭秘肠癌免疫逃逸新机制
B淋巴细胞在肿瘤免疫中的研究是新近热点。在实体肿瘤中发现B细胞浸润及其构成的三级淋巴结构(Tumor-associated tertiary lymphoid structures,TLS)与抗肿瘤免疫激活、免疫治疗响应密切相关[1-3]。但是, B细胞也通过肿瘤免疫微环境与免疫调节发挥促肿瘤免疫抑制效应[4-6],后者的研究存在较多空白[7, 8]。因此,剖析肿瘤浸润B细胞的特性及其调节功能的获得机制,才能全面了解肿瘤相关B细胞,并建立相应的免疫干预策略。
2022年6月3日,复旦大学储以微/刘荣花团队在Immunity杂志上发表了题为Leucine-tRNA-synthase-2-expressing B cells contribute to colorectal cancer immunoevasion的研究论文。团队利用单细胞技术分析了结直肠癌(Colorectal cancer, CRC)不同阶段的肿瘤浸润B细胞,发现一群高表达亮氨酸tRNA合成酶2(LARS2)的B细胞新亚群(LARS B)。这群LARS B不仅具有TGF-β1主导的调节性特征,而且具有亮氨酸营养偏好。因此,研究者从营养与代谢视角解析了肿瘤浸润B细胞获得调节功能的机制,并提出通过限制亮氨酸饮食清除LARS B细胞、激活抗肿瘤免疫效应。
在该项研究中,研究团队通过收集小鼠CRC局部组织,分选肿瘤浸润CD45+细胞进行单细胞测序,分析发现LARS B亚群独立于FOB、GCB和PC亚群,以高表达Lars2为主要特征(图1)。细胞表型上,LARS B类似浆细胞前体细胞,表达浆细胞驱动基因Prdm1,但抗体分泌能力较低,Cd138低表达,相反高表达抑制性分子Tgfb1,与Treg细胞通讯密切。组织定位上,LARS B散布于TLS以外的肿瘤间质,在正常组织以及骨髓、脾脏、外周血极少存在。进一步,研究人员通过收集临床CRC患者的肿瘤组织、息肉和配对的正常组织及外周血,证实LARS B也存在于CRC患者。90例CRC患者的组织芯片染色结果显示,组织内LARS B的富集与不良预后呈现正相关。

图1 AOM+DSS小鼠结直肠癌模型的肿瘤局部B细胞图谱
研究团队分析了LARS B形成的原因和功能。他们发现,相比其他氨基酸,亮氨酸在肿瘤浸润B细胞内呈现高富集现象;在化学诱导和原位肿瘤两种CRC小鼠模型中,高亮氨酸饮食使肿瘤局部产生更多的LARS B,促进肿瘤进展(图2)。过继转输Lars2缺失的B细胞至免疫缺陷小鼠(CD79a-/-)以及在B细胞中条件性敲除Lars2(Cd79a-Cre Lars2fl/fl),肿瘤明显减小,并伴随着TGF-β1的分泌以及Treg的减少。LARS B对TGF-β1依赖的调节性特征和对Treg形成的影响,也通过LARS B分选、T/B细胞共孵育以及Tgfb1条件性敲除小鼠得到了验证。
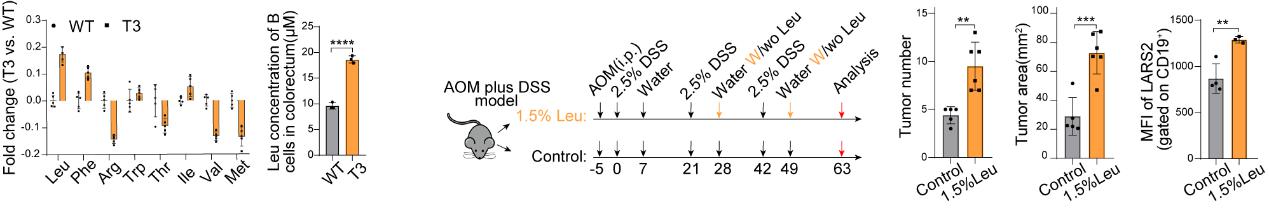
图2 亮氨酸诱导LARS B细胞
在机制研究中,研究人员发现LARS B的核心基因LARS2主要定位在线粒体,负责线粒体基因翻译,包括线粒体呼吸链复合体I-V。相较于瘤内的其他B细胞亚群,LARS B的线粒体代谢增强,特别是NAD+的再生,而NAD+依赖的去乙酰化酶SIRT1通过去乙酰化转录因子PAX5,使其与Tgfb1启动子区的结合能力增强,促进了Tgfb1转录,是LARS B获得调节功能的重要机制。
基于LARS B的亮氨酸依赖性特点,研究人员提出了一种安全有效的亮氨酸节律饮食方案(7天为一个周期:4天正常饮食,3天亮氨酸缺失饮食),该饮食方案显著抑制LARS B细胞介导的结直肠癌免疫逃逸,减缓了肿瘤进展(图3)。这个氨基酸节律饮食 ,对临床肠癌的防治和患者的个人饮食管理提供应用潜能。

图3 亮氨酸节律饮食抑制LARS B细胞介导的结直肠癌免疫逃逸
复旦大学基础医学院免疫学系的博士生王志强、中山医院内镜中心主治医师林生力以及肝外科博士后陆舟为该论文的共同第一作者,复旦大学基础医学院及生物医学研究院储以微教授和生物医学研究院青年研究员刘荣花为该论文的共同通讯作者。该课题得到了国家自然科学基金重点项目、自然科学基金创新团队和上海市启明星青年人才计划的资助。
原文链接:https://doi.org/10.1016/j.immuni.2022.04.017
参考文献:
1.Helmink, B.A., et al., B cells and tertiary lymphoid structures promote immunotherapy response. Nature, 2020. 577(7791): p. 549-555.
2.Cabrita, R., et al., Tertiary lymphoid structures improve immunotherapy and survival in melanoma. Nature, 2020. 577(7791): p. 561-565.
3.Petitprez, F., et al., B cells are associated with survival and immunotherapy response in sarcoma. Nature, 2020. 577(7791): p. 556-560.
4.Xiao, X., et al., PD-1hi Identifies a Novel Regulatory B-cell Population in Human Hepatoma That Promotes Disease Progression. Cancer Discov, 2016. 6(5): p. 546-59.
5.Shalapour, S., et al., Inflammation-induced IgA+ cells dismantle anti-liver cancer immunity. Nature, 2017. 551(7680): p. 340-345.
6.Liu, R., et al., MicroRNAs 15A and 16-1 Activate Signaling Pathways That Mediate Chemotaxis of Immune Regulatory B cells to Colorectal Tumors. Gastroenterology, 2018. 154(3): p. 637-651 e7.
7.Schwartz, M., Y. Zhang, and J.D. Rosenblatt, B cell regulation of the anti-tumor response and role in carcinogenesis. J Immunother Cancer, 2016. 4: p. 40.
8.Hoffman, W., F.G. Lakkis, and G. Chalasani, B Cells, Antibodies, and More. Clin J Am Soc Nephrol, 2016. 11(1): p. 137-54.