Cell Reports丨胡维国课题组报道补体C5a/C5aR1信号在结直肠癌发生中发挥关键作用
结直肠癌(Colorectal Cancer, CRC)是常见的消化道恶性肿瘤之一,近年来其发病率呈现逐年上升且年轻化的趋势。研究表明,CRC发病机制复杂,涉及遗传、环境、炎症及肠道菌群等在内的诸多因素。已有研究发现,先天免疫系统的关键组成部分——补体系统在结直肠癌中广泛激活,但关于其发挥的作用及机制鲜有报道。复旦大学生物医学研究院/附属肿瘤医院胡维国团队一直以来致力于补体系统在肿瘤发生发展中的作用及其机制研究,前期在Theranostics杂志报道,补体C5,尤其是C5ar1基因敲除几乎完全阻止AOM/DSS诱导的小鼠CRC发生。机制研究表明,结直肠炎症局部产生的C5a通过与髓源性抑制细胞 (myeloid-derived suppressor cells, MDSCs) 膜上的受体C5aR1结合,招募MDSCs至炎症局部,抑制CD8+ T细胞增殖与功能,并调控一系列关键促炎细胞因子(TNF-α, IL-1α/β, IL-6和IL-17A等)、抑炎细胞因子(IL-23, IL-9, IL-27和IL-10等)与趋化因子(CCL2, CCL17, CXCL1和CXCL5等)的产生与释放,从而诱导CRC的发生 (Ding et al., 2020)。
近年来,越来越多的研究逐渐揭示补体不但可以在细胞外的血液循环中激活,还可在CD4+ T细胞 (Arbore et al., 2016; Liszewski et al., 2013)和CD8+ T细胞 (Arbore et al., 2018)等免疫细胞内激活,这让我们对补体系统的激活和功能有了全新的认识。然而,在非免疫类细胞,尤其是在上皮肿瘤细胞内是否存在细胞内补体激活现象,以及相应的作用和机制还鲜有报道。
2022年5月31日,胡维国团队在Cell Reports杂志在线发表了题为“Intracellular complement C5a/C5aR1 stabilizes β-catenin to promote colorectal tumorigenesis”的研究论文。该工作报道了在肠上皮细胞内也存在补体C5的激活,所产生的活性产物C5a与其受体C5aR1结合,在细胞内调控关键分子β-catenin的蛋白稳定性,从而促进CRC的发生发展。上述研究结果为结直肠癌的预防和治疗提供了新的思路。

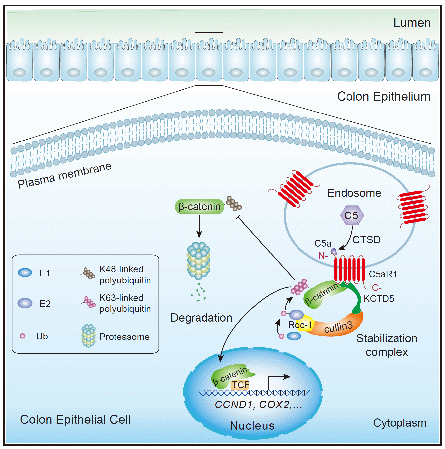
该研究首先在包括肠上皮/肠癌细胞系在内的10余种组织类型共40余种细胞系中,检测发现这些细胞系均表达C5和C5aR1。需特别指出的是,C5aR1作为一种经典的GPCR蛋白,并不表达于肠上皮/肠癌细胞的细胞膜表面,而是定位于细胞质中的内体或溶酶体上。进一步研究发现,胞内C5蛋白在组织蛋白酶D(Cathepsin D, CTSD)的作用下被切割激活产生活性片段C5a,与内体/溶酶体上的C5aR1结合后,进一步与KCTD5/cullin3/Roc1/β-catenin相互作用形成稳定复合体,促进β-catenin发生K63位多聚泛素化修饰,同时抑制其发生K48位多聚泛素化修饰,进而增强β-catenin蛋白稳定性。 研究人员进一步使用C5和C5ar1基因敲除小鼠,构建了慢性结肠炎相关结肠癌(AOM/DSS-induced CAC model)和散发性结肠癌(ApcMinC-based sporadic CRC model)疾病模型,发现敲除C5或C5ar1可显著抑制肠道组织β-catenin的蛋白水平及激活,进而显著抑制结直肠癌的发生。进一步,使用C5aR1拮抗剂PMX205处理亦可显著抑制结直肠癌的发生,提示C5aR1可作为预防甚至治疗结直肠癌的潜在治疗靶点。更重要的是,研究人员进一步证实了细胞内补体C5激活及其介导的β-catenin稳定机制在其他多种类型的肿瘤细胞中均存在,提示这一信号通路可能存在更为广泛的生物学意义。
复旦大学生物医学研究院/附属肿瘤医院胡维国研究员为本文的通讯作者,复旦大学附属肿瘤医院研究助理丁佩佩博士为本文第一作者,复旦大学生物医学研究院/附属肿瘤医院雷群英教授和嵇庆海教授参与完成了这一工作,并给予了大力支持。据悉,该课题得到了国家重大研究计划,基金委重大、创新群体、重大研究计划、面上和青年项目等资助。
原文链接:https://doi.org/10.1016/j.celrep.2022.110851
参考文献:
Arbore, G., West, E.E., Rahman, J., Le Friec, G., Niyonzima, N., Pirooznia, M., Tunc, I., Pavlidis, P., Powell, N., Li, Y., et al. (2018). Complement receptor CD46 co-stimulates optimal human CD8(+) T cell effector function via fatty acid metabolism. Nat Commun 9, 4186. 10.1038/s41467-018-06706-z.
Arbore, G., West, E.E., Spolski, R., Robertson, A.A.B., Klos, A., Rheinheimer, C., Dutow, P., Woodruff, T.M., Yu, Z.X., O'Neill, L.A., et al. (2016). T helper 1 immunity requires complement-driven NLRP3 inflammasome activity in CD4(+) T cells. Science 352, aad1210. 10.1126/science.aad1210.
Ding, P., Li, L., Li, L., Lv, X., Zhou, D., Wang, Q., Chen, J., Yang, C., Xu, E., Dai, W., et al. (2020). C5aR1 is a master regulator in Colorectal Tumorigenesis via Immune modulation. Theranostics 10, 8619-8632. 10.7150/thno.45058.
Liszewski, M.K., Kolev, M., Le Friec, G., Leung, M., Bertram, P.G., Fara, A.F., Subias, M., Pickering, M.C., Drouet, C., Meri, S., et al. (2013). Intracellular complement activation sustains T cell homeostasis and mediates effector differentiation. Immunity 39, 1143-1157. 10.1016/j.immuni.2013.10.018.