Nature Metabolism丨雷群英团队揭示BCAT1的E61A突变加速肿瘤进展
缬氨酸、亮氨酸和异亮氨酸由于其结构上存在的侧链被统称为支链氨基酸(BCAA),属于人体必须氨基酸。BCAA摄入体内后的分解代谢首先在支链氨基酸代谢酶1和/或2(BCAT1, 2)催化下,生成支链酮酸(BCKA),进而在线粒体内逐步代谢生成乙酰辅酶A等代谢物(图1)。BCAA还可以作为信号分子调控体内信号通路。BCAA的代谢和感知失衡在肥胖和肿瘤等代谢性疾病中发挥重要作用。
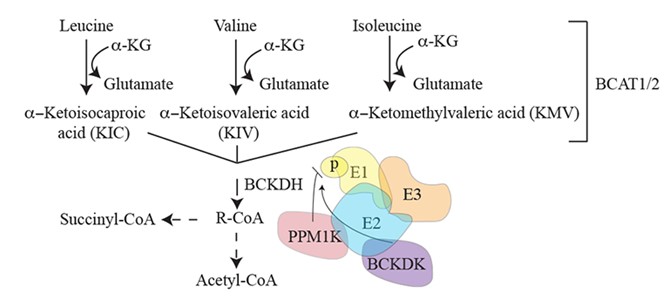
图1. 支链氨基酸代谢(摘自Emerging Roles for Branched-Chain Amino Acid Metabolism in Cancer. Cancer cell, 37(2), 147–156)。
复旦大学生物医学研究院/附属肿瘤医院雷群英课题组近年来先后发现了BCAA代谢在肥胖和胰腺癌中的重要作用,揭示了BCAT2介导的BCAA分解代谢不依赖于mTOR信号通路,在肥胖和胰腺癌发生发展过程中的关键机制,并提出了饮食和药物靶向干预的新策略(Nature Cell Biology 2020;National Science Review 2021,Nature Metabolism 2022)。在此基础上,该团队进一步探索肿瘤发生发展中BCAA代谢重编程和信号感知的新机制。他们的最新研究成果“Enhanced BCAT1 activity and BCAA metabolism promotes RhoC activity in cancer progression”于2023年6月19日,在Nature Metabolism上线发表。

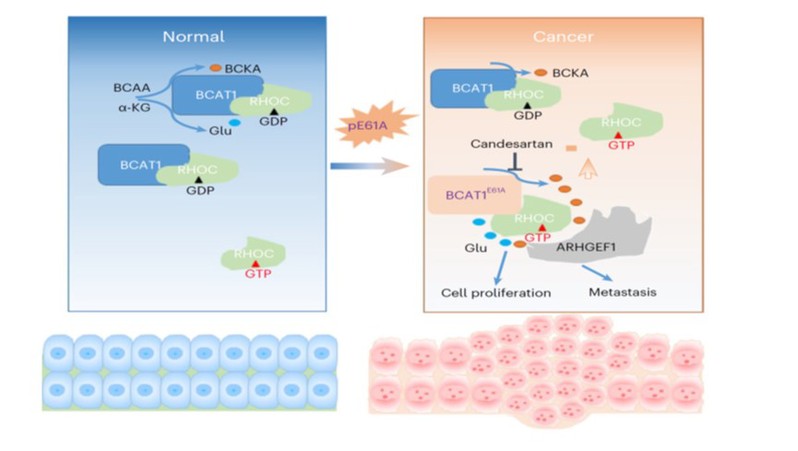
研究人员利用肿瘤细胞系百科全书(CCLE)数据库,分析BCAA代谢途径中的重要代谢酶的突变结果显示,在部分胃癌细胞和白血病细胞中,谷氨酸(Glu,E)-丙氨酸(Ala,A)的高频突变存在于编码BCAT1的第61位密码子(BCAT1E61A)。经测序分析,证实在2.8%的人胃癌组织样品也存在BCAT1E61A, 并且这些BCAT1E61A突变阳性组织病理诊断为弥散性胃癌。
借助酶生物化学,细胞学、稳定同位素标记代谢流追踪以及体内动物试验,研究人员证实BCAT1E61A造成其催化BCAA代谢酶活性升高,细胞增殖和迁移能力增强,促进肿瘤的发展和转移,在敲减BCAT1的肿瘤细胞中过表达BCAT1/BCAT1E61A或用BCKA处理,均能补救细胞迁移能力。深入的机制分析,显示BCAT1E61A突变一方面增强了BCAT1直接结合、活化小G蛋白成员之一的RhoC分子。另一方面,BCAA代谢生成的BCKA也能够结合并活化RhoC,调控细胞骨架重组。
令人感兴趣的是,该团队在以前的研究中,发现血管紧张素II受体拮抗剂替米沙坦抑制BCAT2酶活,而在本研究中筛选鉴定到另一个血管紧张素II受体拮抗剂-坎地沙坦有效抑制BCAT1/BCAT1E61A的酶活,并利用细胞和动物实验证实坎地沙坦抑制肿瘤细胞的迁移和转移。最后,研究人员在小鼠中诱导胃、肝和肺等不同类型肿瘤,发现Bcat1KI/KI 敲入的转基因小鼠中的肿瘤发生发展均显著高于对照小鼠。特别是长期喂养的Bcat1KI/KI 转基因小鼠能自发发生肝癌。
该结果证实BCAT1E61A为功能获得性突变,造成BCAA代谢增强,促进肿瘤发生发展。值得注意的是,该研究从分子机制层面阐明了BCAA区室化代谢调控,以及BCKA通过RhoC介导的代谢感知,调控细胞迁移和增殖,揭示了肿瘤中BCAA代谢的异质性,对靶向BCAA代谢重塑的临床诊疗,提供了新的靶点,有重要的转化意义。
复旦大学生物医学研究院/附属肿瘤医院钱林博士、李娜博士、陆孝晨博士研究生和许蜜蝶副研究员为论文共同第一作者,雷群英教授为本文通讯作者。此外,论文合作作者还包括复旦大学上海医学院的多位教授和上海交通大学基础医学院吴英理教授、中国科学院分子细胞科学卓越创新中心陈正军研究员等。该研究受到了国家自然科学基金、科技部重点基础研发项目和上海市教委科创项目等的支持。
论文链接:
https://www.nature.com/articles/s42255-023-00818-7