Cell Reports丨温文玉团队与合作者揭示神经干细胞增殖分化调控新机制
哺乳动物大脑中有近千亿的神经元,数量如此庞大的神经元却是由数量相对较少的神经干细胞在脑发育早期分化而来。神经元由神经干细胞分化后迁移到皮质特定位置,并遵循“由内到外”(inside-out)的原则进行分布,即早期生成的神经元分布在皮质深层的位置,晚期生成的神经元则分布在皮质浅层的位置。由神经元构成的复杂神经功能网络,是大脑行使高级功能的基础。因此,精确调控神经干细胞的增殖与分化是大脑中特定数量神经元发生的关键机制。
神经干细胞是一种高度极性化的细胞,胞体定位在脑室区(ventricular zone),通过顶端纤维(apical process)和基底纤维(basal process)分别连接着大脑皮质的脑室区和脑膜(pial surface)。细胞极性的建立与维持对于细胞的增殖、分化和形态形成等生理过程具有重要意义,当细胞极性出现缺陷则可以导致皮质发育异常。早期研究发现位于顶端纤维末端的极性蛋白 Par3 对于神经干细胞的增殖与分化平衡具有重要作用,但具体机制还不十分清楚。
2023年6月22日,复旦大学脑科学研究院解云礼研究员课题组与生物医学研究院温文玉研究员课题组合作,在Cell Reports在线发表了Ccdc85c-Par3 condensates couple cell polarity with Notch to control neural progenitor proliferation的研究论文。该研究运用了生物化学等手段揭示了神经干细胞中极性蛋白通过相分离方式调控其增殖与分化,为深入理解大脑神经发生提供了新的见解。

作者首先利用生化手段鉴定出了一个新的与Par3相互作用的极性蛋白Ccdc85c,通过小鼠胚胎电转的方式验证了Ccdc85c在神经干细胞发育过程中的重要作用。进一步研究发现,Par3和Ccdc85c共定位于神经干细胞终足末端的同一位置,暗示Ccdc85c对于神经干细胞发育的调控作用可能与Par3结合相关。通过体外生物化学等手段,作者发现Ccdc85c的螺旋结构域与Par3的4N2结构域相结合,并且二者结合后有助于解开Par3的自抑制构象,从而形成蛋白质凝聚液滴(图1)。
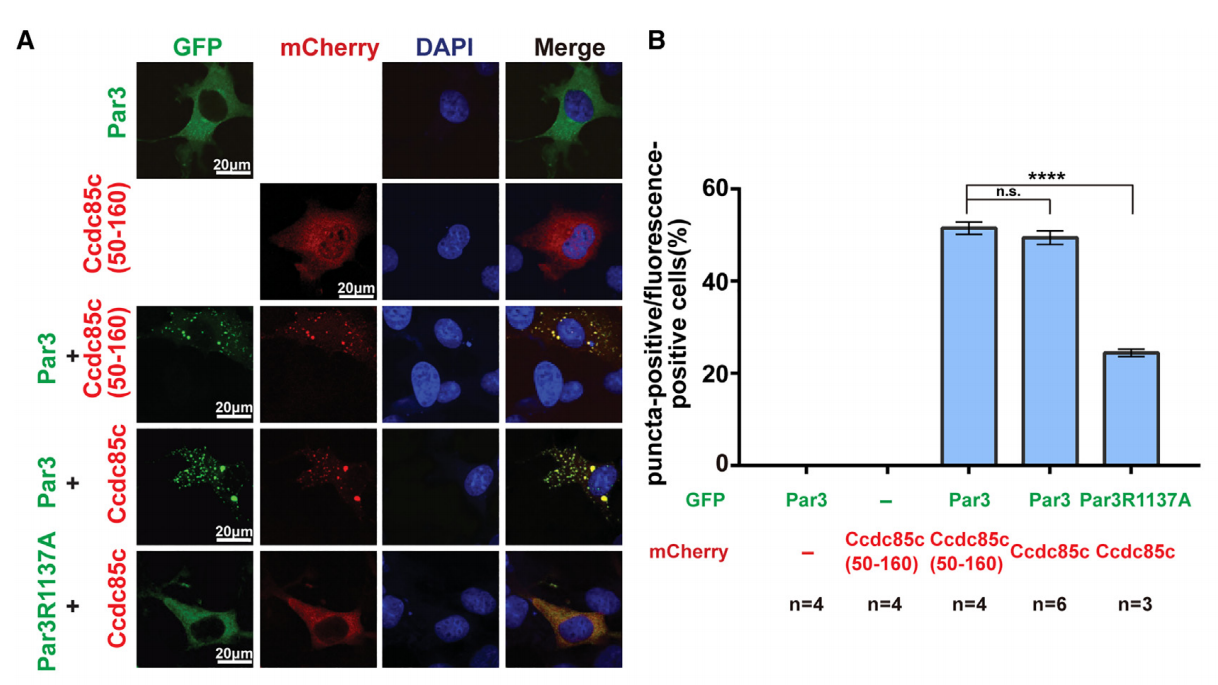
图1. Ccdc85c和Par3结合有助于解开Par3自抑制构象
为了进一步研究Ccdc85c和Par3结合后调控神经干细胞发育的分子机制,结合FRET、FRAP等技术,作者发现解开自抑制构象后的Par3能够发生相分离从而募集更多的Numb蛋白,该蛋白是Notch信号通路的抑制因子,从而使得神经干细胞的Notch信号通路能够维持在特定水平保持增殖状态(图2)。

图2.Ccdc85与Par3结合调控神经干细胞发育的分子机制
综上所述,该研究揭示了Ccdc85c这一极性蛋白在神经干细胞发育过程中的作用,并证实了Ccdc85c是与Par3极性蛋白的结合后通过相分离的方式募集更多的Numb,从而维持神经干细胞中的Notch信号通路水平,确保神经干细胞实现增殖与分化间的平衡。该研究解析了神经干细胞极性蛋白精确调控其增殖分化的分子机制,为深入了解大脑神经发生提供了新的见解。
复旦大学徐嘉文、邓鑫、顾爱红和蔡玉群为本文的共同第一作者,解云礼研究员和温文玉研究员为共同通讯作者。本研究得到了 STI2030 重大项目、国家重点研发计划项目、国家自然科学基金、上海市科技重大专项、张江实验室和上海脑科学与类脑技术中心的支持。