Nature Communications丨孙蕾课题组与合作者开发基于宿主因子的抗新冠病毒广谱性疗法
现有的抗新冠病毒小分子药物主要靶向病毒主蛋白酶或RNA聚合酶,但由于新冠病毒为高突变的RNA病毒,存在产生耐药性的风险。因此,如何应对病毒的耐药性,仍是备受瞩目的关键科学问题。
2023年11月21日,复旦大学生物医学研究院孙蕾研究员联合上海科技大学免疫化学研究所/生命科学与技术学院双聘教授杨海涛、上海科技大学免疫化学研究所特聘教授姜标,广州实验室陈新文研究员、武汉病毒所张磊砢研究员等团队在Nature Communications上合作发表了基于宿主蛋白酶进行抗新冠病毒药物开发的最新研究成果“Structure-based discovery of dual pathway inhibitors for SARS-CoV-2 entry”,报道了多种靶向新冠病毒入侵过程中关键宿主蛋白酶TMPRSS2和CTSB/CTSL的抑制剂及其分子机制,并证实同时抑制以上蛋白酶可协同产生更有效的抗病毒作用。该研究为基于宿主蛋白酶的抗新冠病毒广谱性药物开发奠定了重要基础。

新冠病毒在入侵过程中,既能通过质膜融合直接入侵(见下图左,途径A),也能在细胞内吞途径中完成膜融合(见下图右,途径B),释放病毒基因组。在两条入侵通路中,膜融合过程的发生分别需要依赖TMPRSS2和CTSB/CTSL对病毒刺突蛋白进行切割并激活其构象,从而介导后续的膜融合反应。由于宿主蛋白酶在新冠病毒的入侵过程中不可或缺的重要地位及其作为宿主蛋白相较于病毒蛋白保守性高,不易突变的特性,被认为是抗新冠病毒广谱性药物开发的理想靶点。
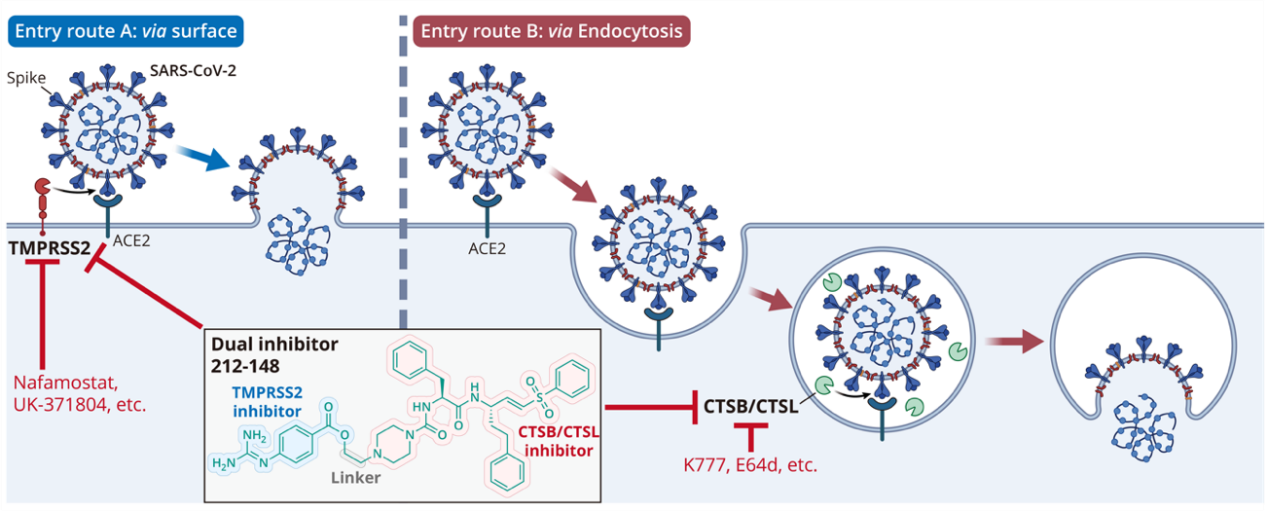
新冠病毒入侵的两条途径及靶向其中宿主蛋白酶的抑制剂
研究团队以TMPRSS2和CTSB/CTSL为研究对象,通过高通量筛选发现了多种具有靶向能力的强效抑制剂,并在细胞水平上展现出nM量级的抗病毒效果。研究团队进一步利用X-射线晶体学方法解析了上述多种抑制剂与其相应蛋白靶点的复合物结构,揭示了抑制剂靶向抑制的分子机制。值得一提的是,其中TMPRSS2与抑制剂的复合物结构首次揭示了TMPRSS2完整胞外域的结构信息。此外,研究团队发现联合使用靶向TMPRSS2和CTSB/CTSL的抑制剂分子nafamostat和K777,在抗病毒实验中具有更好的抗病毒效果(EC50=0.9 nM),表现出“1+1>>2”的协同效应,表明同时抑制两条入侵通路是抗新冠药物开发的有效策略。在上述结构与抗病毒研究基础上,研究团队进一步设计了同时靶向TMPRSS2和CTSB/CTSL的“双活性”抑制剂212-148(见上图),其不仅在酶活试验中展现出双重抑制能力,同时也在细胞水平上展现出对不同新冠病毒突变株如Delta与Omicron感染的拮抗效果。
本项工作由上海科技大学、复旦大学、广州实验室和武汉病毒研究所等多家单位合作完成。上海科技大学免化所博士后王镐锋、广州实验室副研究员杨琪、上海科技大学免化所博士生刘小策、许孜立、硕士生邵茂林为论文的并列第一作者。上海科技大学杨海涛教授、复旦大学孙蕾研究员、上海科技大学姜标教授,广州实验室陈新文研究员、武汉病毒研究所张磊砢研究员为本文的共同通讯作者。晶体衍射数据收集在上海同步辐射光源和英国Diamond光源完成。该研究受到国家自然基金委、科技部、广州实验室和上海市科委等多个基金项目的支持。
文章链接:https://doi.org/10.1038/s41467-023-42527-5