分子细胞生物学团队揭示ASXL1突变促进白血病发生发展的新机制
ASXL1(Additional sex combs-like)与BAP1(BRCA1-associated protein 1)组成的PR-DUB蛋白复合物是一类重要的表观遗传调控因子,它通过催化组蛋白H2AK119ub的去单泛素化(H2AK119ub1),影响染色质凝缩状态和调控基因转录。已知ASXL1在多种髓系血液肿瘤中发生突变,如骨髓增生异常综合征(MDS)、骨髓增生性肿瘤(MPN)、急性髓系白血病(AML)、慢性淋巴细胞白血病(CLL)等,其突变往往发生在ASXL1第12个外显子附近,导致该蛋白翻译过程的提前终止,进而产生ASXL1缺失C端的截短型突变。近年来,已有研究相继报道C端截短型ASXL1的突变蛋白能增强BAP1的去泛素化酶活性,影响髓系造血细胞分化(Balasubramani et al. Nat Commun. 2015);还获得与BET家族中最重要的功能蛋白BRD4的结合能力,影响组蛋白乙酰化水平,导致ASXL1突变细胞对BET抑制剂类抗癌药物的敏感度增加(Yang et al. Blood. 2018)。与众多表观遗传修饰酶类似,ASXL1与BAP1均不具备识别特定DNA序列的蛋白结构域。那么,PR-DUB蛋白复合物如何被招募到染色质上,将H2AK119ub1等表观遗传信息传递并决定靶基因转录,从而发挥其生物学功能?
近日,复旦大学生物医学研究院分子细胞生物学团队(简称“MCB团队”)回答了上述部分重要科学问题,揭示了ASXL1突变促癌的新机理,相关成果于7月18日以“Tumor-derived neomorphic mutations in ASXL1 impairs the BAP1-ASXL1-FOXK1/K2 transcription network”为题在线发表在Protein & Cell杂志上。

该研究主要发现:1)由ASXL1与BAP1构成的PR-DUB蛋白复合物,通过与FOXK1和FOXK2等能识别特定DNA序列的转录因子结合,进而被招募到基因组特定区域(如基因启动子等),降低该区域组蛋白H2AK119ub1水平,转录激活下游靶基因,如VHL, SOCS1/2,TXNIP等抑癌基因;2)在血液肿瘤中,C端截短型ASXL1突变蛋白仍然结合BAP1,却完全丧失了与FOXK1和FOXK2蛋白的结合能力,导致ASXL1突变体通过显性负性突变效应(dominant-negative effect),显著削弱BAP1-ASXL1-FOXK1/K2复合物的转录调控功能,下调系列抑癌基因的表达,进而调控葡萄糖代谢、缺氧感知、JAK-STAT等肿瘤相关信号通路,促进白血病细胞增殖、自我更新,并抑制缺氧状态下的细胞凋亡。
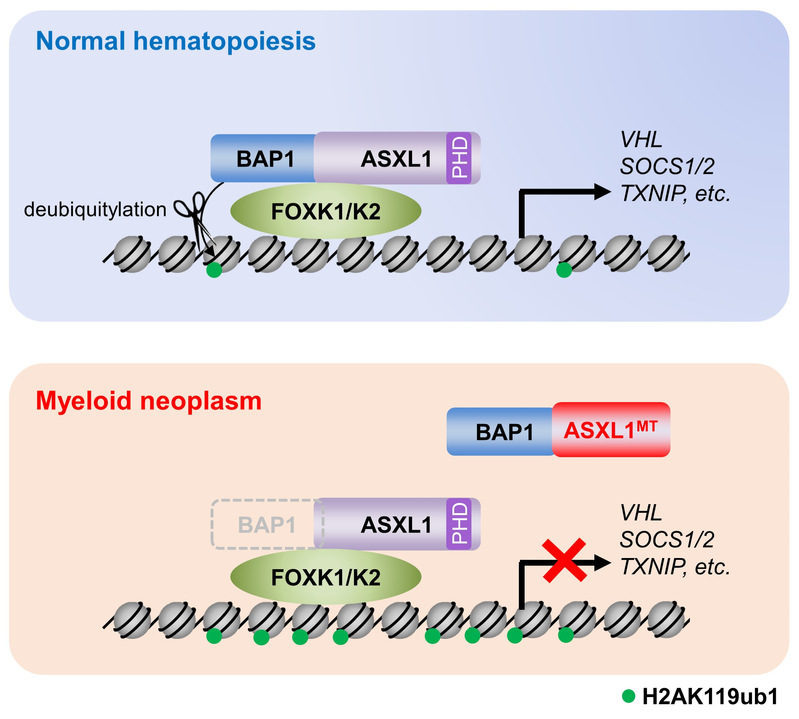
图1. 肿瘤来源ASXL1突变抑制BAP1-ASXL1-FOXK1/K2转录调控网络
事实上,除了FOXK1和FOXK1之外,ASXL1和BAP1还分别与众多能识别特定DNA序列的转录因子结合,该工作丰富了我们对PR-DUB蛋白复合物决定下游靶基因转录的科学认知,也将为深入探讨ASXL1和BAP1突变如何调控肿瘤相关信号通路提供新的研究思路。
据悉,复旦大学博士夏玉坤、博士生曾伊蓉为本文共同第一作者,复旦大学生物医学研究院叶丹研究员为通讯作者。该工作还得到了复旦大学生命科学学院丁琛教授、复旦大学生物医学研究院杨桢副教授、中国科学院上海生命科学研究院植物生理生态研究所杨琛研究员、上海交通大学医学院唐玉杰教授的大力支持。
原文链接:https://doi.org/10.1007/s13238-020-0075