Leukemia丨石玉衡/高海/徐国良团队报道了cGAS-STING 通路在介导TET2 缺失导致的CH发生中的作用
克隆性造血(Clonal hematopoiesis, CH)是造血干细胞由于基因突变而引起的异常扩增的现象,并会导致多种血液系统恶性疾病的发生。目前的研究指出TET2是CH中最常突变的基因之一,并且与CH的发生密切相关。TET2的主要功能是催化 DNA 上5-甲基胞嘧啶(5mC)的氧化,并最终通过碱基切除修复系统完成 DNA 主动去甲基化过程。然而迄今为止,TET2功能缺失导致 CH发生以及后续的恶性血液疾病的转化的具体调控机制和关键信号通路仍未完全明确。
2023年10月10日,复旦大学生物医学研究院青年副研究员石玉衡与合作者课题组在Leukemia杂志上发表了文章题为“STING activation in TET2-mutated hematopoietic stem/progenitor cells contributes to the increased self-renewal and neoplastic transformation”,该研究首次报道了cGAS-STING 通路在介导TET2 缺失导致的CH发生中的作用,并证明了抑制该信号同路可以有效的缓解TET2缺失诱发的小鼠血液系统发育异常以及后续的血液系统恶性疾病。

研究人员通过分析野生型和 Tet2 缺失小鼠骨髓中不同分化阶段血液细胞的转录组测序数据,发现STING 信号通路相关基因的表达以及下游的炎症因子水平在 Tet2缺失的造血干/祖细胞 (hematopoietic stem/progenitor cells, HSPCs) 中显著升高。进一步研究发现,Tet2 缺失的 HSPCs 会自发产生DNA损伤。这些损伤的DNA片段会进一步激活了cGAS-STING 信号通路,进而促进了 I 型干扰素等内源性炎症因子的产生。利用转基因小鼠模型,研究人员证明了Tet2 缺失小鼠HSPCs 异常扩增且向髓系细胞分化的倾向增强,但 Tet2 和Sting双敲除小鼠的造血系统表型则趋于正常;并且在骨髓移植模型中,Tet2 和Sting双敲除小鼠相比于 Tet2单敲除小鼠生存期得到了显著延长。
同时,利用Patient derived xenograft (PDX)模型,研究者证明了STING 抑制剂可以也同样可以特异性抑制携带TET2 突变的AML病人异种移植小鼠的发病进程。这一结论与小鼠模型结果呈现了高度的相似性,从另一角度提示了STING可能是一个在人类TET2突变相关血液系统疾病发生发展过程中的潜在的干预靶点。
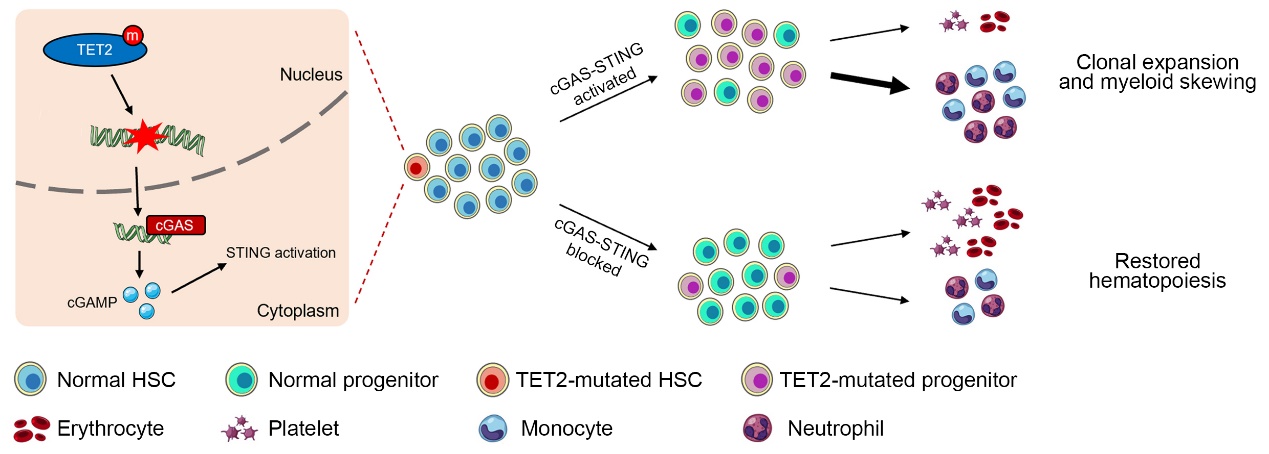
这一研究内容充分揭示了 STING 信号通路在 TET2 功能缺失导致的CH 及血液系统恶性肿瘤发生发展中的重要作用;证实了由于 TET2 缺失内源性产生的慢性炎症对其CH以及血液恶性肿瘤发展具有重要的推动作用。本研究为 TET2 功能缺失突变导致的血液系统异常的内在机制提供了新的见解,也为开发CH及血液恶性肿瘤的治疗策略提供了一个新的切入点。
复旦大学生物医学研究院博士研究生谢佳颖、技术员盛梦瑶博士、博士研究生荣少钦、青年副研究员周丹为论文的第一作者。本项目由国家自然科学基金委,科技部重点研发计划,中国医学科学院创新单元,复旦大学附属中山-徐汇中心医院提供了经费支持。
原文链接:https://www.nature.com/articles/s41375-023-02055-z