PNAS丨王磊/桑庆团队与合作者发现线粒体呼吸链蛋白COX15缺陷诱导铁死亡导致人卵退化
线粒体是细胞的能量工厂。但与体细胞相比,卵母细胞线粒体比较特殊:形态呈圆形,且线粒体嵴少、活性较低,提示卵母细胞线粒体功能可能具有独特调控机制(Hum Reprod Update, 2016)。前期已有大量研究发现,线粒体相关蛋白功能异常会导致线粒体疾病。这些疾病通常表现为个体发育迟缓或性成熟前死亡等,因而无法评估相关线粒体蛋白异常在人卵发育和女性生育力中的作用。线粒体蛋白功能缺陷是否能直接导致人卵发育异常,至今未有报道。
2024年10月29日,复旦大学生物医学研究院王磊、桑庆、张治华团队联合上海交通大学附属第九人民医院匡延平团队在PNAS杂志以Research article形式发表题为COX15 deficiency causes oocyte ferroptosis的文章,首次发现线粒体呼吸链相关基因COX15的隐性突变通过激活铁死亡通路导致人卵退化和女性不孕,研究进一步利用多个基因敲除及点突变鼠模型揭示了病理机制并探索了潜在干预策略。

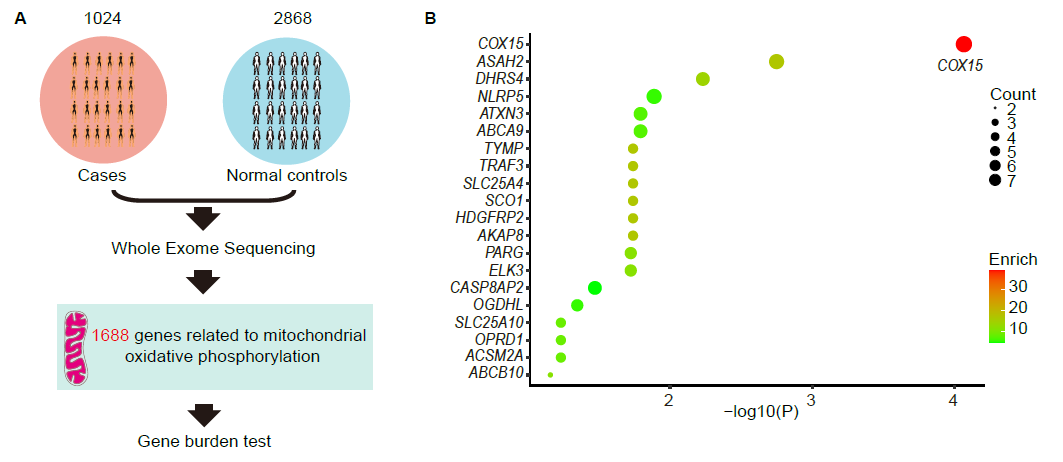
图1 COX15突变在卵子质量低下患者中高度富集
研究人员首先选取1088例卵子发育异常的不孕患者和2868例正常女性对照的全外显子数据,针对线粒体功能相关基因开展基因负荷分析,结果发现线粒体呼吸链复合体IV成员基因COX15的隐性突变在卵子质量低下患者中高度富集(图1),共发现7名患者携带COX15隐性突变,其中6均携带R222C罕见频发变异,遗传学证据强烈提示COX15是导致卵子质量低下的候选致病基因。体外生化实验和酵母生长实验表明COX15突变破坏了蛋白自身的正常表达,并严重影响酵母的呼吸作用,初步证实了突变的致病性。进一步借助卵母细胞条件性删除小鼠和患者来源的双点突变小鼠模型,成功模拟了患者的临床表型,建立了突变与表型的因果关系。机制研究发现,COX15缺陷导致卵母细胞内Fe2+和ROS累积,进而导致线粒体功能紊乱并激活铁死亡通路导致卵子退化(图2)。最后,研究人员发现体内和体外抑制铁死亡可以部分逆转Cox15缺陷导致的卵子退化表型,为患者干预和治疗提供了理论参考。
通过不同突变对比发现,如果突变对COX15功能破坏比较严重(如已报道R217W),则患者会表现为线粒体呼吸链复合体IV缺陷,通常在出生后或青春期前死亡(AJHG, 2003)。而本研究中的患者大都携带R222C突变位点,该突变对COX15功能破坏相对较弱,患者仅表现为卵子退化和不孕表型,表现为一因多效现象。同时说明卵母细胞和体细胞对于线粒体功能缺陷的耐受性截然不同,背后机制值得深入探索。
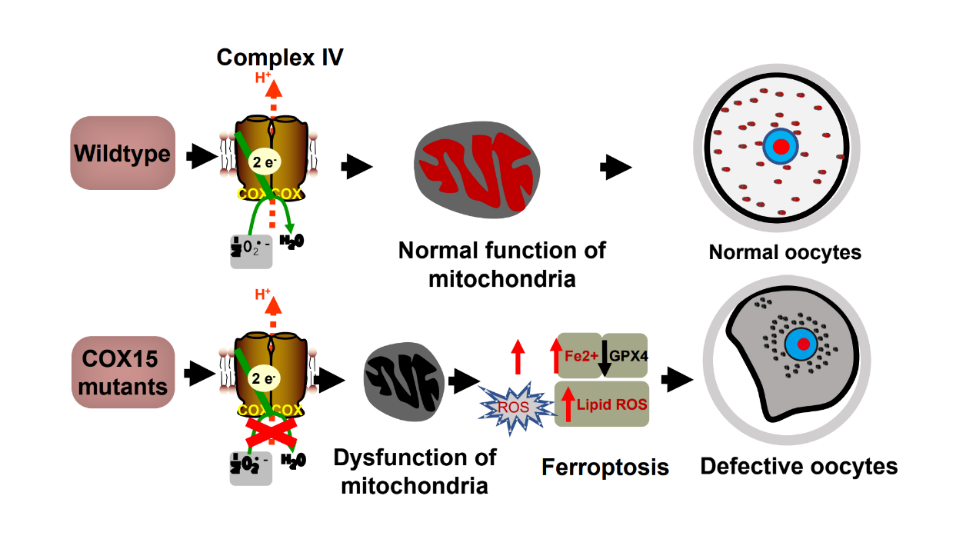
图2 线粒体蛋白COX15缺陷通过诱导铁死亡导致人卵退化
综上所述,本研究首次发现线粒体相关基因COX15突变会诱导人卵铁死亡,进而导致卵子退化和不孕。研究不仅为卵母细胞发育缺陷提供新的精确诊疗依据,同时扩展了线粒体疾病的表型谱,并将此种独特的人卵退化和不孕纳入线粒体疾病范畴。
复旦大学生物医学研究院王磊、桑庆、张治华及上海交通大学附属第九人民医院匡延平为通讯作者。团队副研究员张治华、博士生余然、广西医科大学第三附属医院史秋雯、国科大杭州高等研究院博士后吴至竞、滨州医学院附属医院李清春和团队青年副研究员穆健为本文共同第一作者。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2406174121