生物医学研究院/附属肿瘤医院何祥火团队系列研究成果聚焦恶性肿瘤的发生发展与治疗
人类基因组蕴藏着数目巨大的非编码RNA基因。基因组学研究表明,哺乳动物基因组只有不到2%转录为蛋白质,而超过98%转录为非编码RNA(ncRNA)。其中长链非编码RNA(Long noncoding RNAs, lncRNAs)是一类长度大于200个核苷酸、没有或者微弱编码蛋白能力的非编码RNA。近年研究发现,lncRNA广泛参与各种生物学过程,如调控细胞增殖、细胞转移、细胞分化、细胞凋亡等;LncRNA的异常表达与人类各种疾病尤其与恶性肿瘤的发生发展密切相关,相关研究已成为当今肿瘤研究领域的热点和重要科学问题。LncRNA数量繁多,大部分lncRNA功能不清,绝大多数lncRNAs分子调控机制不明确。

近年来,复旦大学生物医学研究院、附属肿瘤医院教授何祥火领导的研究团队对非编码RNA在人类恶性肿瘤特别是肝癌中的作用、分子机制及临床意义进行了深入系统的研究,取得一系列创新性研究成果,充分揭示非编码RNA不仅在肿瘤的发生发展与转移中发挥重要作用,而且可作为癌症诊断与分型、转移复发与预后预测分子标志物,为肿瘤精准诊断与精准治疗带来新的机遇。2020年第一季度,何祥火团队先后在国际知名肿瘤学杂志《分子肿瘤》(Molecular Cancer)、《肝脏病学》(Hepatology)和《癌症研究》(Cancer Research)上发表四篇研究论文,聚焦恶性肿瘤的发生发展与治疗。
1月21日,《分子肿瘤》(Molecular Cancer)杂志在线发表了何祥火研究团队论文《缺氧诱导长非编码RNA LUCAT1通过PTBP1可变剪接通路调节癌细胞活性及化疗治疗反应》(“Hypoxia induced LUCAT1/PTBP1 axis modulates cancer cell viability and chemotherapy response”)。该研究发现了一个能够显著受缺氧诱导上调的长链非编码RNA LUCAT1与PTBP1结合,调控下游DNA损伤与凋亡相关基因的可变剪切,调控肠癌细胞的细胞周期、DNA损伤与凋亡。LUCAT1能够促进肠癌细胞在体外与体内的生长,以及肠癌细胞在体外和体内对于化疗药物的抵抗。LUCAT1在肠癌组织中显著上调,并且对高表达LUCAT1的肠癌病人往往有着较差的预后和较差的化疗效果。
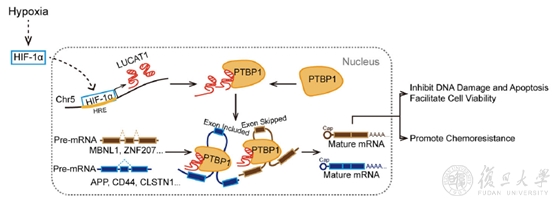
何祥火为本文通讯作者,生物医学研究院副研究员梁琳慧及肿瘤医院大肠外科主任徐晔为本文的共同通讯作者。生物医学研究院博士生还林为本人第一作者,肿瘤医院大肠外科硕士生郭天安为本文共同第一作者。
2月21日,《肝脏病学》(Hepatology)杂志在线发表了何祥火研究团队论文《炎症诱导的长非编码RNA LINC00665通过激活PKR/NF-κB信号通路增加肝癌的侵袭性》(“Inflammation-induced LINC00665 increases the malignancy through activating PKR/NF-κB pathway in hepatocellular carcinoma”)。该研究在肝癌中发现了一个受NF-κB信号通路调控新型信号分子长链非编码RNA LINC00665。研究发现,LINC00665在肝癌中的表达还受DNA甲基化的调控,LINC00665的高表达与TNM分期、BCLC分期呈正相关,且LINC00665高表达的肝癌患者预后较差。体内外的功能实验揭示LINC00665可以显著促进肝癌细胞的生长与成瘤。LINC00665通过与其相互作用蛋白双链RNA激活蛋白激酶PKR结合,抑制其泛素化降解,维持 PKR 的稳定性,增强 PKR 的激活,进而参与肝癌细胞NF-κB信号的激活。NF-κB信号通路是连接炎症和肿瘤发生的重要途径,此研究发现炎症LINC00665/PKR/NF-κB正反馈环在肝癌发生发展中起着重要的作用,其可能是肝癌治疗的一个重要的潜在靶点。
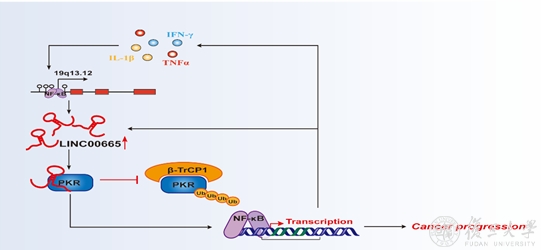
何祥火为本文通讯作者,生物医学研究院副研究员赵莹珺为本文的共同通讯作者,肿瘤医院副研究员丁洁为本文第一作者。
3月25日,《肝脏病学》(Hepatology)杂志发表了何祥火研究团队论文《剪接因子NONO通过调控BIN1基因剪接促进肝癌细胞的增殖以及转移》(“Splicing Regulator p54nrb /Non-POU Domain-Containing Octamer-Binding Protein Enhances Carcinogenesis Through Oncogenic Isoform Switch of MYC Box-Dependent Interacting Protein 1 in Hepatocellular Carcinoma”)。该研究发现RNA结合蛋白NONO在肝癌样本中高表达,能够调节BIN1发生致癌异构体转换。
体内外实验发现NONO促进了肝癌细胞的增殖以及转移能力。研究人员进一步发现NONO可以结合下游靶基因前体RNA,其中敲低NONO可以引起MYC Box–Dependent Interacting Protein 1(BIN1)的剪接过程。在正常肝脏细胞中NONO低表达,下游靶基因BIN1产生更多的短转录本(BIN1-S),通过抑制cMYC对下游靶基因启动子结合抑制肝细胞的增殖和转移;而在肝癌中NONO异常高表达。NONO通过结合DExH-box helicase9(DHX9)以及splicing factor proline and glutamine–rich (SFPQ)对BIN1基因剪接,产生更多长转录本(BIN1-L),BIN1-L通过结合polo-like kinase 1(PLK1)并稳定其蛋白稳定性发挥促癌功能。在肝癌患者中,NONO常常和DHX9以及SFPQ共同高表达,同时高表达NONO以及SFPQ的肝癌患者显示更差的预后和更高的术后复发概率。新发现的RNA结合蛋白复合物DHX9/NONO/SFPQ对于肝癌患者的预后和精准治疗提供了潜在可能。

何祥火、赵莹珺以及中山医院肝外科主任医师高强为该论文的通讯作者,生物医学研究院博士生胡治祥和中山医院肝外科博士生董良庆为该论文的共同第一作者。
3月正式出版的《癌症研究》(Cancer Research)杂志发表了何祥火研究团队论文《长末端重复序列来源的长非编码RNA lncMER52A通过调控p120-ctn/Rac1/Cdc42信号通路促进肝癌侵袭转移》(“An LTR Retrotransposon-Derived Long Noncoding RNA lncMER52A Promotes Hepatocellular Carcinoma Progression by Binding p120-Catenin”)。研究发现lncMER52A是一个衍生于MER52A内源逆转录病毒LTR的lncRNA,其在肝癌中特异高表达,而在癌旁正常肝组织和其他组织中不表达(除睾丸、胎盘)。lncMER52A的表达与肝癌病人的临床特征密切相关。lncMER52A高表达的肝癌病人TNM分期更高,肿瘤细胞分化差,其预后也显著差于lncMER52A低表达的肝癌病人。进一步研究lncMER52A的功能,发现lncMER52A可促进肝癌细胞体内外的侵袭和转移。这些结果说明,lncMER52A可作为肝癌的一个促癌因素,促进肝癌的恶化进程。由于lncMER52A只在肝癌中特异表达,因此其十分有潜力成为肝癌治疗的新靶标。此外,单因素和多因素分析也表明,lncMER52A可作为肝癌的独立预后因子,因此lncMER52A也可发展为肝癌诊断的一个新的生物标志物。
进一步研究lncMER52A发挥功能的机制,发现lncMER52A结合上皮-间质转化的关键调控蛋白p120-catenin,并增加p120-catenin稳定性,诱导其下游效应蛋白Rac1和Cdc42的活化,进而诱导肝癌细胞发生上皮-间质转化,促进肝癌的侵袭和转移。另外,初步探索lncMER52A在肝癌中异常表达的分子机制,发现lncMER52A的转录由MER52A LTR衍生的启动子区驱动。该启动子区的组蛋白活化修饰与lncMER52A的表达密切相关,且转录因子YY1介导了lncMER52A在肝癌中的转录。MER52A LTR可在不同的癌症中异常激活,但在不同的癌症中,其激活的位点并不一致,说明MER52A LTR的异常激活可能导致了不同的癌症特异转录本的产生。MER52A LTR在癌症中如何被激活,其组蛋白修饰的改变由何因素引起值得进一步研究。

梁琳慧为本文通讯作者,何祥火和肿瘤医院研究员黄胜林、为本文的共同通讯作者。肿瘤医院硕士生武扬军和肝外科副主任医师赵一鸣为本文共同第一作者。肿瘤医院肝外科教授王鲁为本文临床研究提供了临床标本和指导。
论文信息
1.Lin Huan†, Tianan Guo†, Yangjun Wu, Linguo Xu, Shenglin Huang, Ye Xu*, Linhui Liang*, Xianghuo He*. Hypoxia induced LUCAT1/PTBP1 Axis Modulates Cancer Cell Viability and Chemotherapy Response. Molecular Cancer, 2020 Jan 21;19(1):11.
论文链接:https://doi.org/10.1186/s12943-019-1122-z
2.Jie Ding, Jingjing Zhao, Lin Huan, Yizhe Liu, Yejun Qiao, Zhen Wang, Zhiao Chen, Shenglin Huang, Yingjun Zhao*, Xianghuo He*. Inflammation-induced LINC00665 increases the malignancy through activating PKR/NF-κB pathway in hepatocellular carcinoma. Hepatology, 2020 Feb 21
论文链接:https://aasldpubs.onlinelibrary.wiley.com/doi/abs/10.1002/hep.31195
3.Hu, Z., Dong, L., Li, S., Li, Z., Qiao, Y., Li, Y., Ding, J., Chen, Z., Wu, Y., Wang, Z., Huang, S., Gao, Q. *, Zhao, Y. *, and He, X. * (2020) Splicing Regulator p54(nrb)/Non-POU Domain-Containing Octamer-Binding Protein Enhances Carcinogenesis Through Oncogenic Isoform Switch of MYC Box-Dependent Interacting Protein 1 in Hepatocellular Carcinoma. Hepatology,2020 Mar 25
论文链接:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.31062
4.Yangjun Wu†, Yiming Zhao†, Lin Huan, Jingjing Zhao,Yuqiang Zhou, Linguo Xu, Zhixiang Hu, Yizhe Liu, Zhiao Chen, Lu Wang, Shenglin Huang*, Xianghuo He*, Linhui Liang*. A LTR retrotransposon derived long non-coding RNA lncMER52A promotes hepatocellular carcinoma progression by binding p120-catenin. Cancer Research, 2020 Mar 1
论文链接:https://cancerres.aacrjournals.org/content/80/5/976
制图:郑佳欣