王磊团队与合作者在《Cell Research》解析人源Pannexin 1通道的结构与功能
2020年3月12日,我院王磊课题组与中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)竺淑佳课题组以及中科院上海药物所余学奎课题组合作完成了题为“Cryo-EM structure of human heptameric Pannexin 1 channel”(《人源七聚体Pannexin 1通道的冷冻电镜结构》)的研究论文,合作解析了人源Pannexin 1通道的结构与功能。

细胞之间的交流是细胞发育及细胞稳态维持的基础。Pannexin蛋白通道家族是一类大孔径通道,在细胞与细胞之间的交流过程中起着至关重要的作用。其中,Pannexin 1是研究最为广泛的一种亚型。它广泛参与三磷酸腺苷(ATP)及离子的通透,与多种生理和病理功能密切相关。前期,王磊课题组在四个独立家系中发现由Pannexin 1基因突变引起的孟德尔显性遗传病,这些突变体通过影响蛋白糖基化和加速 ATP 释放最终导致卵子死亡(Sang et al., Sci Transl Med. 2019)。在此研究中,竺淑佳课题组通过爪蟾卵母细胞的电生理实验,证实这些突变体可以激活Pannexin 1通道的活性。但因缺乏Pannexin通道蛋白的高分辨率三维结构,限制了这些突变体分子机制的解析及靶向药物的设计。
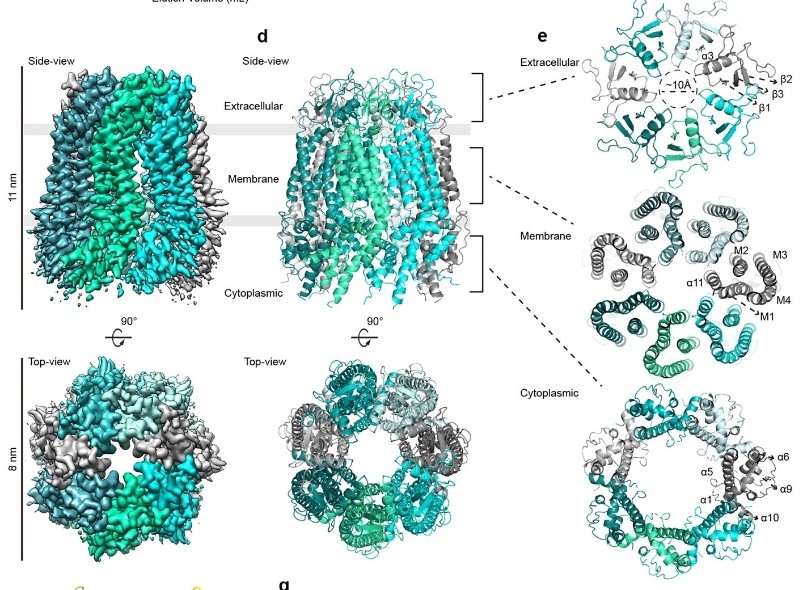
研究人员通过真核细胞重组表达了人源野生型Pannexin 1蛋白,并摸索了蛋白纯化条件。用单颗粒冷冻电镜解析了3.2埃分辨率的人源野生型PANX1三维结构,并揭示其七聚体的组装形式,完全不同于之前领域内普通认为Pannexin 1是六聚体通道的结论。通过结构的分析,研究人员进一步解析了ATP通透的限制性位点,揭示了胞外端74位的色氨酸形成一个直径小于10埃的门控环。结合ATP通透性检测、观察突变体表型、电生理记录等一系列功能学实验, 进一步证实了74位的色氨酸对ATP通透的选择性调控机制。Pannexin 1通道蛋白的结构与功能解析,将为与人类Pannexin 1基因突变相关疾病的治疗药物开发提供重要信息。
复旦大学研究生曲荣贵负责所有的生化及功能实验,药物所博士后冬黎黎参与了数据分析及模型搭建,为该论文共同第一作者。卓越中心研究助理张继林参与了数据采集及功能实验。IBS为第一单位及共通讯单位。本项目得到科技部国家重点研发计划、中国科学院战略性先导科技专项(B类)、上海市科技重大专项、上海市启明星项目等基金的支持。
原文链接:https://www.nature.com/articles/s41422-020-0298-5