张晓燕和Jun-O Jin团队在《Nature Communications》报道大肠杆菌粘附素FimH蛋白作为佐剂可用于肿瘤免疫治疗
长期以来,癌症作为一种病因复杂的异质性疾病,被认为是全球范围内最致命的疾病之一。随着医学水平的不断进步,癌症的治疗手段不断更新换代,免疫疗法作为一种新兴的癌症治疗手段引起学者们地广泛关注,其中通过诱导机体内树突状细胞(Dendritic Cells,DCs)的成熟,进而引发抗原特异性免疫应答是癌症免疫治疗的一种有效途径[1]。然而,有效免疫佐剂的缺乏成为这一治疗途径的重要限制因素。
FimH是大肠杆菌等革兰氏阴性菌表面I型菌毛的粘附素,位于I型菌毛的尾端,是一种高度保守的蛋白[2]。研究表明,FimH与致病性大肠杆菌(Escherichia coli,E. coli)的粘附和移动有关[3],基于FimH的系统性疫苗接种可有效预防黏膜E. coli侵染[4]。据报道,FimH作为一种Toll样受体4(Toll Like Receptor 4,TLR4)的配体,通过与TLR4结合,可激活小鼠和人的NK细胞[5]。但其作为免疫佐剂应用于抗癌症免疫治疗方面的研究尚未见报道。
2020年3月4日,我院张晓燕团队CO-PI Jun-O Jin组在Nature Communications上在线发表论文“Escherichia coli adhesion portion FimH functions as an adjuvant for cancer immunotherapy”,在小鼠体内和人外周血细胞中共同揭示大肠杆菌粘附素FimH在癌症免疫治疗中的佐剂效应,为癌症免疫治疗佐剂提供新的候选。

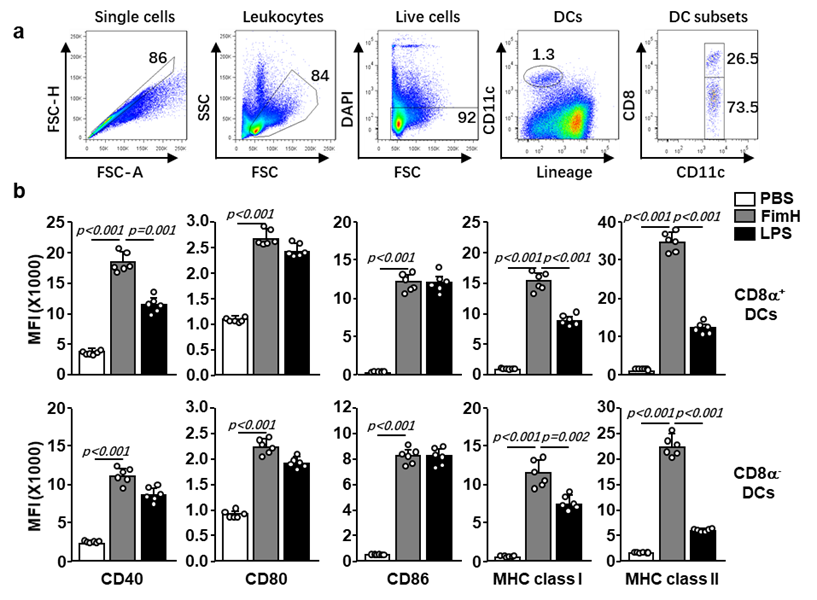
研究者借助大肠杆菌pET28a表达纯化了FimH蛋白,并分别在小鼠体内和人外周血细胞中证明FimH处理可有效诱导相应DCs亚群的活化,并通过增强Th1和Tc1细胞发挥作用。同时通过利用基因敲除小鼠证明FimH对DCs的活化依赖于TLR4但不依赖于髓样分化蛋白2(MD2)。
在DCs研究基础上,研究者进一步在小鼠体内和人外周血中证明FimH可有效诱导抗原特异性T细胞增殖和免疫应答,并利用模式抗原OVA和肿瘤自体抗原在肿瘤小鼠体内证明抗原和FimH联合应用可有效抑制小鼠体内肿瘤细胞的生长,同时小鼠体内抗原特异性细胞因子表达的细胞数显著增多。
基于FimH作为I型菌毛最表面的粘附素,拥有与机体黏膜结合的天然优势,研究者对FimH的黏膜佐剂作用进行了评估,通过小鼠鼻腔注射发现FimH可通过黏膜途径诱导DCs活化,并进而促进抗原特异性T细胞增殖,同时肿瘤抗原和FimH联合作用可显著抑制小鼠肺部肿瘤生长,增加体内抗原特异性细胞的数量。
考虑到免疫检查点阻断的同时促进癌症抗原特异性的免疫反应已成为现如今有极大应用潜力的免疫治疗方式,本研究最后研究者在动物模型中对FimH联合抗-PD-L1的免疫增强效应进行探究,并证明抗-PD-L1和FimH共同作用可消除肿瘤生长,增强抗肿瘤效果。
综上所述,本课题围绕大肠杆菌粘附素FimH在动物模型和人外周血中多方面、多角度证明其作为新型免疫佐剂可有效诱导DCs活化,促进抗原特异性免疫应答,进而发挥抗癌作用,同时对FimH作为黏膜佐剂和联合免疫检查点共同作用的可能性进行了探讨,为基于DCs的癌症免疫治疗提供新的佐剂候选以及实验依据。
据悉,Jun-O Jin课题组研究助理张薇和徐丽为论文共同第一作者,Jun-O Jin教授为本文通讯作者,本课题工作得到了复旦大学附属上海市公共卫生临床中心、生物医学研究院徐建青教授和张晓燕教授的大力支持。本研究得到了国家自然科学基金的经费支持。
原文链接:https://www.nature.com/articles/s41467-020-15030-4.pdf
参考文献
1.Sabado, R.L., S. Balan, and N. Bhardwaj, Dendritic cell-based immunotherapy. Cell Res, 2017. 27(1): p. 74-95.
2.Mydock-McGrane, L.K., T.J. Hannan, and J.W. Janetka, Rational design strategies for FimH antagonists: new drugs on the horizon for urinary tract infection and Crohn's disease. Expert Opin Drug Discov, 2017. 12(7): p. 711-731.
3.Poole, N.M., et al., Role for FimH in Extraintestinal Pathogenic Escherichia coli Invasion and Translocation through the Intestinal Epithelium. Infect Immun, 2017. 85(11).
4.Langermann, S., et al., Prevention of mucosal Escherichia coli infection by FimH-adhesin-based systemic vaccination. Science, 1997. 276(5312): p. 607-11.
5.Mian, M.F., et al., FimH can directly activate human and murine natural killer cells via TLR4. Mol Ther, 2010. 18(7): p. 1379-88.