Nature Cell Biology丨叶丹团队揭示免疫代谢物衣康酸特异性抑制TET双加氧酶
衣康酸(Itaconate, ITA)是近年来在巨噬细胞中发现的具有显著抗炎活性的小分子代谢物。在细菌内毒素脂多糖 (LPS) 刺激下,巨噬细胞发生代谢重编程,线粒体代谢酶IRG1蛋白迅速被诱导表达,催化顺乌头酸脱羧和产生毫摩尔级别高浓度的ITA。Irg1基因敲除小鼠的遗传研究表明,ITA抑制炎症反应基因表达和发挥抗炎作用。之前的研究表明,ITA能抑制琥珀酸脱氢酶(SDH)活性,使得琥珀酸(Succinate)积累和影响三羧酸循环;衣康酸具有一个α,β不饱和羧酸的结构,可通过迈克尔加成反应共价修饰到蛋白质的半胱氨酸残基上,影响KEAP1蛋白激活和KEAP1-NRF2通路,还影响ALODA和GAPDH等活性和抑制糖酵解。然而,这些研究并未阐明ITA如何实现对众多炎症基因的转录调控。该调控是否与表观遗传修饰相关,其功能靶点是什么?都是亟待探索的科学问题。
2022年3月8日,复旦大学生物医学研究院叶丹课题组在Nature Cell Biology杂志上以长文形式发表了题为Itaconate Inhibits TET DNA Dioxygenases to Dampen Inflammatory Responses的研究论文。首次报道ITA是新的调控表观遗传的代谢物分子。发现ITA通过与α-酮戊二酸(α-KG)竞争结合的方式,抑制DNA双加氧酶TET和调控炎症基因表达,并证实TET2是衣康酸抗炎的重要功能靶标。

α-KG被报道与TET2蛋白催化中心H1416、R1896和S1898形成氢键和离子键,并且通过其C-1羧基和C-2酮基与Fe(II)以双齿方式结合。与α-KG类似,ITA也是含五个碳原子的二羧酸,尽管拥有C-1位羧基,但其C-2位上的酮基结构被烯烃所替代和无法与Fe(II) 以双齿方式结合,预示着ITA有可能与α-KG竞争结合TET2蛋白催化中心(图1)。体外的核磁共振和生化实验结果证实,ITA与α-KG类似地结合TET2蛋白,其抑制TET2活性IC50为171µM。
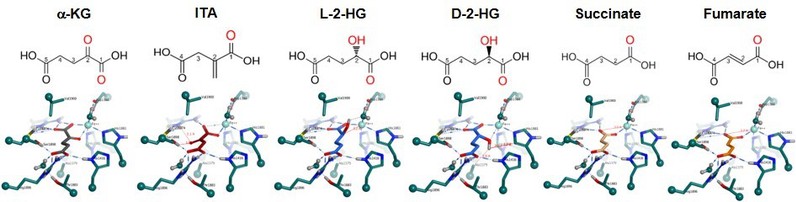
图1. 衣康酸能够结合TET2蛋白催化中心
在巨噬细胞被LPS激活过程中,Irg1 被诱导表达和ITA浓度可高达3-4mM,抑制Tet酶活和RelA-Tet2复合物的DNA去甲基化功能,避免NF-κB和JAK-STATs通路中炎症基因的持续激活。转录组分析表明,~72.5%的LPS诱导炎症基因被Irg1/ITA-Tet2轴调控。在内毒素血症的动物模型中,外源ITA能抑制细胞因子风暴、缓解小鼠肝肺损伤和延长生存期,该保护作用仅发生在野生型小鼠,而在携带Tet2HXD失活突变体的小鼠中并不存在,有力证明了TET2是衣康酸抗炎的重要功能靶标(图2)。
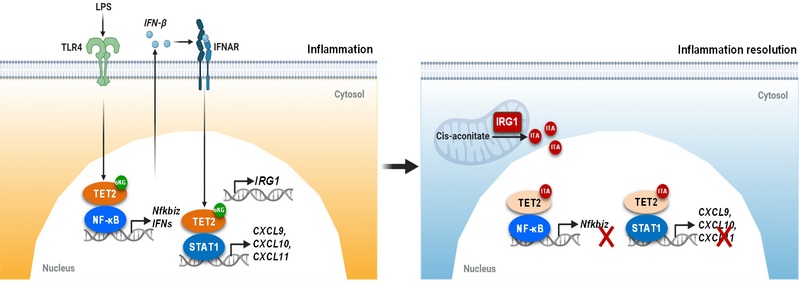
图2. 衣康酸特异性抑制TET双加氧酶和调控炎症基因表达
在前期研究中,叶丹及团队发现代谢酶突变导致内源代谢物高水平积累,如2-羟基戊二酸(2-HG)、延胡索酸(Fumarate)、琥珀酸(Succinate)(Genes Dev. 2012; Mol Cell. 2015),三者均能竞争性结合并抑制-KG/Fe(II)依赖型双加氧酶,包括组蛋白去甲基化酶KDM和DNA去甲基化酶TET等。与上述致癌代谢物在肿瘤细胞中积累不同,衣康酸是巨噬细胞(非肿瘤)中由正常代谢酶催化的产物。衣康酸比已知致癌代谢物对表观修饰酶TET的抑制性和选择性都更强,将为TET特异性抑制剂研发和相关基础研究提供新思路。
复旦大学生物医学研究院青年副研究员陈磊蕾博士、博士后Carmen Morcelle(西班牙籍)以及程舟礼,为本文共同第一作者。该工作得到了北卡罗来纳大学熊跃教授和加州大学圣地亚哥分校管坤良教授的支持,还有浙江大学沈立教授、上海交通大学段才闻研究员、同济大学陈嘉瑜教授、复旦大学生物医学研究院蓝斐研究员、周玉峰研究员以及钱茂祥研究员的合作支持。复旦大学生物医学研究院叶丹研究员为通讯作者。
原文链接:
https://doi.org/10.1038/s41556-022-00853-8