Developmental Cell丨余发星团队揭示细胞群体迁移调控新机制
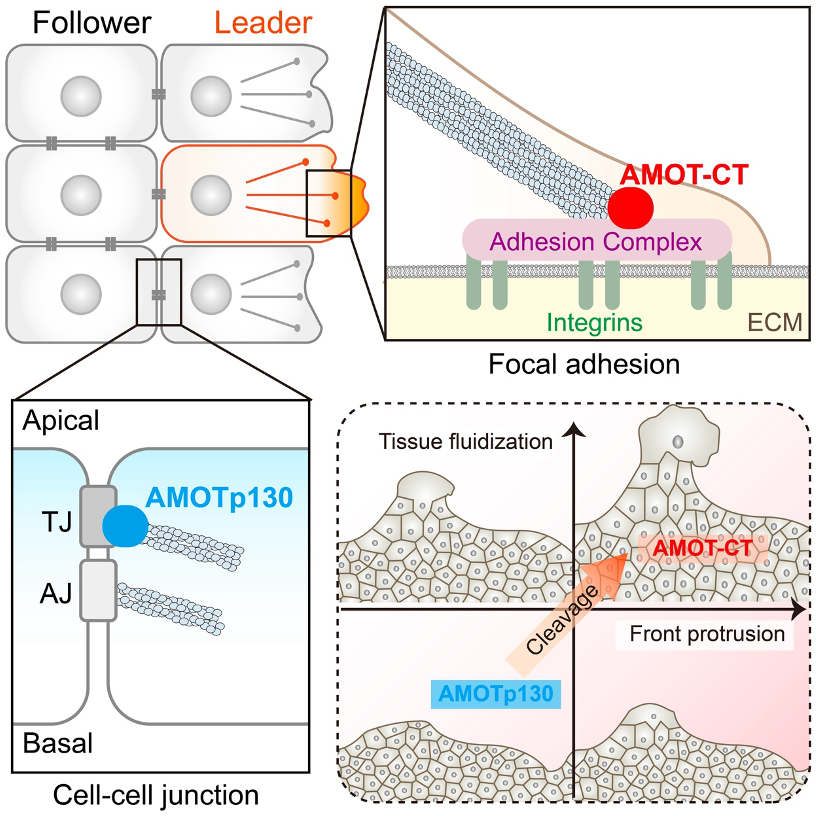
细胞群体迁移(Collective Cell Migration)是多细胞生物中一种重要的迁移方式,参与胚胎发育、伤口愈合和肿瘤转移等多种生理病理过程。在群体迁移中,细胞通过细胞连接保持相互联系,向着同一个目标协同移动。其中,位于迁移前缘的某些细胞会转变为特殊的先导细胞(Leader cell),这些细胞具有强牵引力和显著的极化特征。先导细胞通过拉动跟随细胞(Follower cell),驱动整个细胞群体的迁移。然而,先导细胞如何形成、细胞之间如何协同这些关键问题尚待解答【1】。
2024年10月9日,复旦大学生物医学研究院/附属儿科医院余发星团队在Developmental Cell杂志上发表了题为Angiomotin cleavage promotes leader formation and collective cell migration的研究论文。揭示了Angiomotin(AMOT)蛋白切割活化通路在细胞群体迁移中的作用,阐明了AMOT切割产物促进先导细胞形成的分子机制。

团队前期研究表明,Hippo信号通路成员AMOT蛋白能够发生特异性切割、形成活性切割产物AMOT-CT促进血管新生 【2,3】。该研究延续前期工作,发现在表达AMOT-CT的上皮细胞中,先导细胞的数目显著增加,这些先导细胞具有更多的成熟黏着斑、运动的方向性和持续性显著增强。然而,抑制AMOT切割具有完全相反的作用。进一步研究发现,全长AMOT主要定位于细胞的紧密连接处,切割则促使AMOT转位到细胞骨架和黏着斑区域。AMOT-CT可以和肌动蛋白结合、激活Rho GTPases,从而促进应力纤维的收缩和黏着斑的形成。同时,切割导致全长AMOT在细胞连接处的减少,有助于提升细胞的流动性(fluidity)。因此,AMO的切割作为细胞群体迁移的分子开关发挥双重作用,一方面促进了先导细胞的形成,另一方面提升了跟随细胞的运动协同性。功能试验表明,AMOT-CT可以显著增强小鼠黑色素瘤细胞的肺部定植,以及原位乳腺肿瘤的肺部转移。此外,在AMOT切割位点点突变小鼠中肿瘤血管密度明显降低。这些体内试验结果表明,AMOT切割能够促进肿瘤相关的血管生成和肿瘤细胞的侵袭及转移。
复旦大学生物医学研究院专任副研究员王瑜,博士研究生王业斌、朱雨闻为本文共同第一作者。复旦大学生物医学研究院、附属儿科医院余发星研究员为本论文通讯作者。本研究得到了新加坡国立大学Chwee Teck Lim教授、西湖大学Thuan Beng Saw研究员、中国科学院上海营养与健康研究所胡国宏研究员和复旦大学生物医学研究院刘妍君、叶丹、徐彦辉研究员的大力支持。科技部、自然科学基金委、上海市科委、上海市卫健委为本研究提供了经费支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S1534580724005410?via%3Dihub
余发星课题组研究聚焦器官发育及肿瘤发生过程中的生长调控机制。近期在Molecular Cell, Developmental Cell, The EMBO Journal, Cell Reports Medicine, Science Advances, Cell Reports, Cell Research等期刊发表系列通讯作者论文。迄今,论文引用一万余次,连续入选中国高被引学者及World Top 2%科学家。课题组依托复旦大学生物医学研究院(IBS)和附属儿科医院,研究经费充足(科技部重点研发、基金委杰青等项目支持),现面向海内外英才,诚聘博士后(生物信息学、基因治疗、抗体工程等方向)及技术员(硕士学历)若干,待遇优厚。欢迎志同道合、热爱科研的朋友加入。此招聘长期有效,课题组详情请见复旦IBS官网https://ibs.fudan.edu.cn。
参考文献:
1. Mayor, R., and Etienne-Manneville, S. (2016). The front and rear of collective cell migration. Nat Rev Mol Cell Biol 17, 97-109.
2. Wang, Y., Zhu, Y., Gu, Y., Ma, M., Wang, Y., Qi, S., Zeng, Y., Zhu, R., Wang, X., Yu, P., et al. (2021). Stabilization of Motin family proteins in NF2-deficient cells prevents full activation of YAP/TAZ and rapid tumorigenesis. Cell Rep 36, 109596.
3. Wang, Y., Zhu, Y., Wang, Y., Chang, Y., Geng, F., Ma, M., Gu, Y., Yu, A., Zhu, R., Yu, P., et al. (2023). Proteolytic activation of angiomotin by DDI2 promotes angiogenesis. EMBO J, e112900.