Cell Reports Medicines | 余发星团队报道胸膜间皮瘤基因治疗新策略
胸膜间皮瘤是一种罕见且高度恶性的肿瘤,起源于胸膜表面的间皮细胞,通常与石棉暴露密切相关[1]。现阶段针对胸膜间皮瘤的临床治疗主要以姑息疗法为主。尽管免疫检查点抑制剂等免疫疗法能在一定程度上改善患者的生存状况,但整体疗效有限,患者的中位总生存期仅约为18个月,预后不理想。因此,亟需进一步探索和开发新的策略用于胸膜间皮瘤的治疗。
近年来的研究表明,胸膜间皮瘤的发病机制涉及多种抑癌基因的失活突变。胸膜间皮瘤患者样本的全外显子测序结果显示,NF2、BAP1、CDKN2A/B和TP53等多种抑癌基因在患者中经常发生突变或缺失[2]。此外,LATS2失活突变在间皮瘤患者中也较为常见[2]。NF2和LATS2分别是Hippo抑癌信号通路中的重要接头蛋白和激酶,这些基因的高频突变表明Hippo信号通路在胸膜间皮瘤的发生发展中发挥重要作用,提示Hippo信号通路有潜力成为胸膜间皮瘤治疗靶点。
2024年10月4日,复旦大学生物医学研究院/附属儿科医院余发星团队在Cell Press细胞出版社期刊Cell Reports Medicines上发表了题为“Gene therapy for diffuse pleural mesotheliomas in preclinical models by concurrent expression of NF2 and SuperHippo”的研究论文。该研究报道了一种基于腺相关病毒(AAV)的胸膜间皮瘤基因治疗新策略,并通过小鼠胸膜间皮瘤的遗传肿瘤模型验证了该策略的有效性。

Hippo信号通路通常被视为是一个“线性”激酶级联反应,即MST1/2激酶和MAP4Ks激酶通过作用于LATS1/2激酶来调控YAP/TAZ转录共激活因子[3]。为深入理解LATS1/2和YAP/TAZ如何整合上游信号,余发星团队系统梳理了该信号通路的核心分子网络,提出了HPO1和HPO2两个双信号模块架构,其中WWC和NF2分别介导两个信号模块的活化,并且基于WWC蛋白的作用机制开发了SuperHippo迷你基因分子工具[4,5]。
NF2在胸膜间皮瘤中的失活突变频率高达40%,提示HPO2信号在该疾病中具有潜在调节作用,这一观点已在前人研究中得到验证。本研究通过间皮瘤细胞系和小鼠遗传模型探究了HPO1信号(WWC和SAV1)在间皮瘤中的功能,结果表明:当HPO1信号缺失后,间皮瘤细胞的体外增殖和体内成瘤能力明显增强;而当HPO1和HPO2信号同时缺失时,小鼠胸膜间皮明显增厚并呈现胸膜间皮瘤的特征。因此,HPO1信号同样参与胸膜间皮瘤的疾病进程,活化HPO1信号应该具有抗癌潜力。的确,在小鼠胸膜间皮瘤遗传模型中过表达SuperHippo能够显著抑制肿瘤进展。
基于这些发现,研究团队提出一种“双管齐下”的膜间皮瘤治疗新策略:一方面通过回补NF2恢复HPO2的正常功能,另一方面通过过表达SuperHippo使HPO1超活化,同时提升HPO1和HPO2活性,最大程度地激活Hippo信号通路,从而充分发挥其抑癌功能。由于NF2和SuperHippo基因较小,能够被同一AAV病毒载体携带并表达,实现“一石二鸟”的功效。研究还表明,AAV6可以有效感染间皮细胞,团队最终制备了AAV6-SuperHippo-NF2病毒用于临床前研究。在Nf2/Trp53小鼠胸膜间皮瘤模型中,该病毒显著抑制了肿瘤进展并延长了小鼠生存期,展现了显著的抗癌潜力。
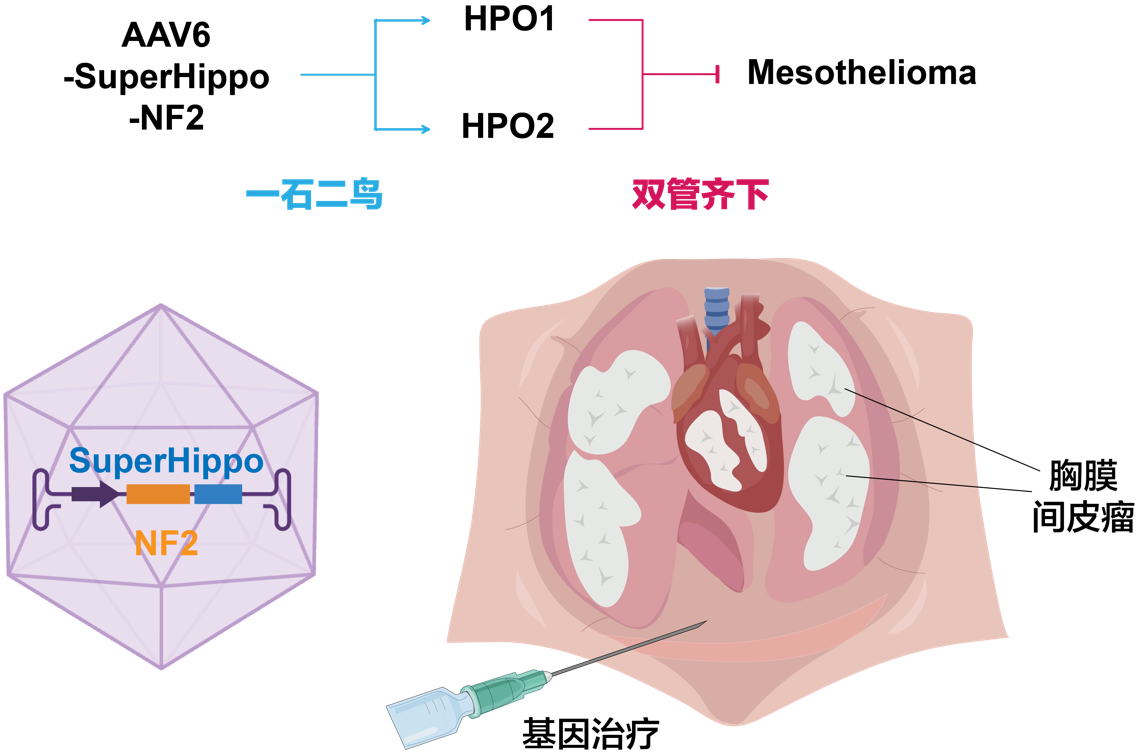
综上,该研究通过胸膜间皮瘤的细胞系及小鼠模型验证了Hippo信号通路,特别是HPO1信号模块,在胸膜间皮瘤中的抑癌作用。此外,研究还提出了一种全新的基因治疗新方案,并在小鼠遗传模型中验证了其可行性。这些发现为通过基因治疗靶向Hippo信号通路治疗胸膜间皮瘤提供了概念性验证,并为后续的临床转化研究奠定了基础。
复旦大学附属儿科医院助理研究员朱锐,复旦大学生物医学研究院研究生柳鑫成为该论文共同第一作者。复旦大学生物医学研究院、附属儿科医院余发星研究员为本论文的通讯作者。本研究得到了复旦大学凌晨研究员、叶丹研究员及韦恩州立大学陈康教授鼎力帮助。科技部、自然科学基金委、上海市科委、上海市卫健委为本研究提供了经费支持。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S2666379124004932
余发星课题组研究聚焦器官发育及肿瘤发生过程中的生长调控机制。近期在Molecular Cell, Developmental Cell, The EMBO Journal, Cell Reports Medicine, Science Advances, Cell Reports, Cell Research等期刊发表系列通讯作者论文。迄今,论文引用一万余次,连续入选中国高被引学者及World Top 2%科学家。课题组依托复旦大学生物医学研究院(IBS)和附属儿科医院,研究经费充足(科技部重点研发、基金委杰青等项目支持),现面向海内外英才,诚聘博士后(生物信息学、基因治疗、抗体工程等方向)及技术员(硕士学历)若干,待遇优厚。欢迎志同道合、热爱科研的朋友加入。此招聘长期有效,课题组详情请见复旦IBS官网https://ibs.fudan.edu.cn。
参考文献:
1. Febres-Aldana CA, Fanaroff R, Offin M, et al. Annu Rev Pathol, 2024, 19:11-42.
2. Badhai J, Pandey GK, Song JY, et al. Combined deletion of Bap1, Nf2, and Cdkn2ab causes rapid onset of malignant mesothelioma in mice. J Exp Med. 2020, 217(6):e20191257.
3. Yu FX, Zhao B, Guan KL. Hippo Pathway in Organ Size Control, Tissue Homeostasis, and Cancer. Cell. 2015, 163(4):811-28.
4. Qi S, Zhu Y, Liu X, Li P, Wang Y, Zeng Y, Yu A, Wang Y, Sha Z, Zhong Z, Zhu R, Yuan H, Ye D, Huang S, Ling C, Xu Y, Zhou D, Zhang L, Yu FX. WWC proteins mediate LATS1/2 activation by Hippo kinases and imply a tumor suppression strategy. Mol Cell. 2022, 82(10):1850-1864.e7.
5. Qi S, Zhong Z, Zhu Y, Wang Y, Ma M, Wang Y, Liu X, Jin R, Jiao Z, Zhu R, Sha Z, Dang K, Liu Y, Lim DS, Mao J, Zhang L, Yu FX. Two Hippo signaling modules orchestrate liver size and tumorigenesis. EMBO J. 2023, 42(11):e112126.