Nucleic Acids Research丨胡晋川课题组发现新的转录偶联修复核心因子STK19
准确和完整的转录是生命活动不可或缺的环节,然而多种内源和外源的DNA损伤可能阻挡RNA聚合酶,干扰正常转录。转录偶联修复(Transcription-Coupled Repair, TCR)是一种从细菌到人类都拥有的DNA修复机制,可以高效修复转录模板链上的损伤,从而保证转录的正常进行。TCR是1985年首先在哺乳动物细胞中发现的,随后证明其是核苷酸切除修复的一条亚途径,利用被损伤阻挡的RNA聚合酶II(PolII)识别损伤并募集下游的通用修复因子完成修复。人类TCR相关基因的缺陷会引起科凯恩综合征(Cockayne syndrome, CS)和UV敏感综合征(UV-sensitive syndrome, UVSS)等遗传疾病。上世纪90年代,通过对CS的研究,鉴定了CSA和CSB两个TCR核心因子;2012年第三个TCR核心因子UVSSA在对UVSS的研究中被发现。到目前为止,人类转录偶联修复还无法在试管中重构,其分子机制也未被完全阐明。是否还存在其它TCR核心因子,以及下游通用修复因子招募的分子细节,一直都是本领域最重要的科学问题。
2024年10月2日,复旦大学生物医学研究院/附属上海市第五人民医院胡晋川课题组在Nucleic Acids Research上发表Breakthrough Article“STK19 is a transcription-coupled repair factor that participates in UVSSA ubiquitination and TFIIH loading”,证明了STK19是一个新的转录偶联修复核心因子并揭示了它参与修复的分子机制,在阐明人类转录偶联修复分子机制的道路上迈出了重要的一步。

STK19(serine/threonine kinase 19,丝氨酸/苏氨酸激酶19)曾经被认为是一个蛋白激酶,与NRAS驱动的黑色素瘤有关,然而最近的结构生物学研究发现它不具有激酶结构域。2016年的一项研究通过多组学筛选发现STK19与细胞的UV敏感性有关【1】,2020年另一项针对多种DNA损伤的大规模筛选再次发现STK19与UV和其它阻挡转录的DNA加合物损伤的细胞敏感性有关【2】。然而,尚不清楚STK19是否参与了TCR,以及如果参与,它与已知的修复因子是如何协同作用的。事实上,如何准确直接地检测TCR,以及TCR因子与损伤的相互作用,一直是本领域的一个难题。
胡晋川课题组前期建立了Damage-seq、XR-seq与PADD-seq等一系列高通量测序技术,分别可以检测损伤、修复以及蛋白-损伤相互作用的全基因组分布。Damage-seq和XR-seq的结果表明人类细胞中STK19缺失会严重阻碍TCR,与经典修复因子CSB缺失的效果类似。利用PADD-seq技术作者发现STK19以一种依赖于CSA的方式被招募到损伤位点,随后作者用AlphaFold2/3等工具预测发现STK19与CSA和RPB1存在相互作用,这两个相互作用都得到了体外pull-down实验的证实。
进一步研究表明STK19不影响UVSSA的招募,但促进了UV照射后UVSSA的单泛素化,而UVSSA单泛素化在TCR过程中发挥着重要作用。然而,表达UVSSA泛素化缺陷突变蛋白的细胞仍然具有一定水平的TCR,STK19缺失完全抑制了残余的修复活性,表明STK19还有不依赖于UVSSA泛素化的功能。PADD-seq实验发现STK19缺失抑制了核苷酸切除修复支架蛋白TFIIH的招募,体外pull-down实验证明STK19与TFIIH复合物具有直接的相互作用。AlphaFold2/3预测发现STK19可以与TFIIH的亚基XPD结合,根据已报道的TCR上游复合物(PolII-ELOF1-CSB-CSA-UVSSA-DNA)、核苷酸切除修复下游复合物(TFIIH-XPA-DNA)结构以及预测的CSA-STK19-XPD三元复合物结构进行叠加后发现TFIIH可以准确定位到PolII下游,提示STK19可以帮助TFIIH以正确的方式装载到DNA模板上。
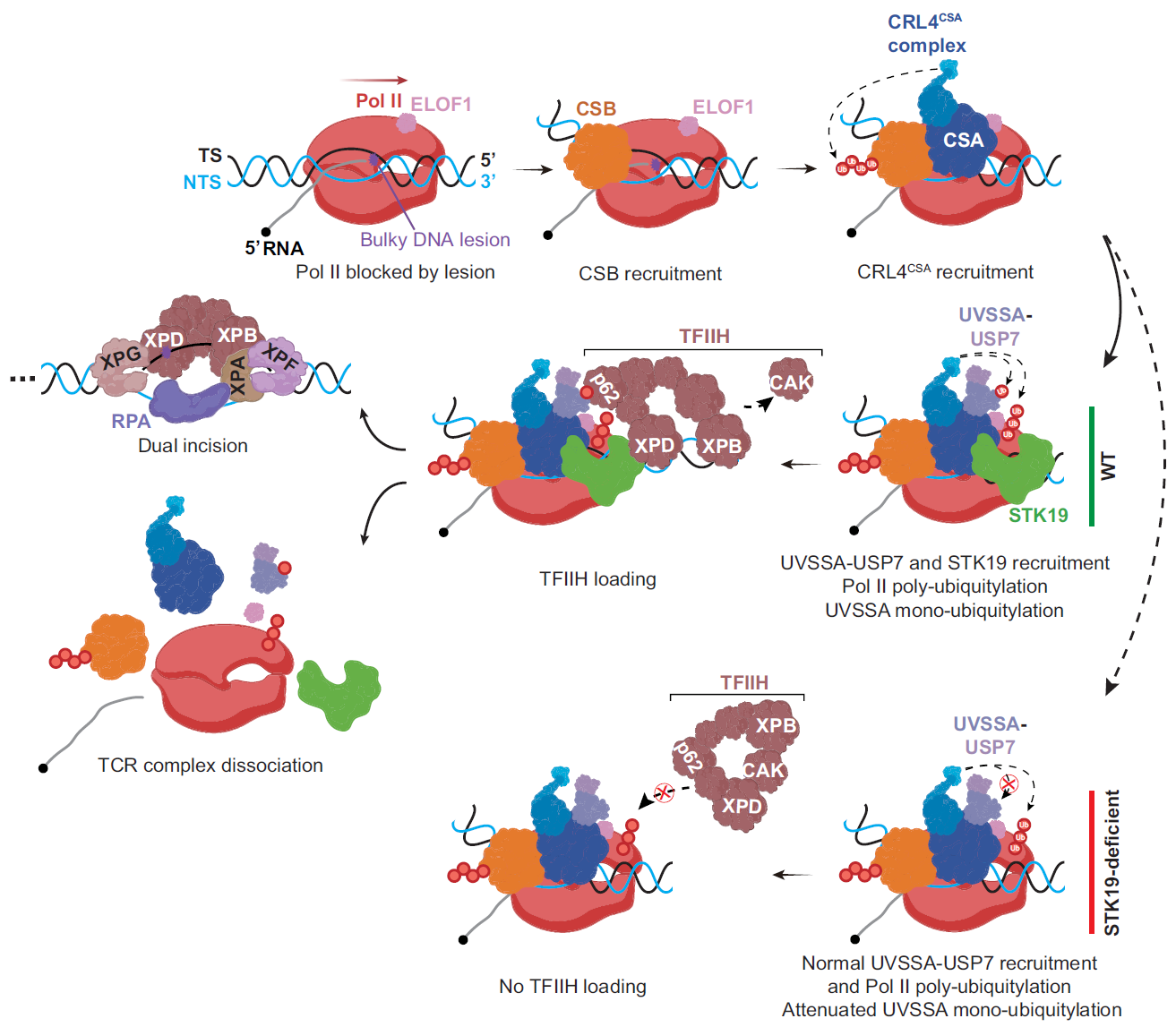
这些结果表明STK19是一个新的TCR核心因子,其功能和机制研究对揭示人类TCR的分子机制具有重要意义。近期研究表明CS导致的早衰与正常衰老具有相似性,因此关于TCR机制的研究对探索衰老的分子机制也有重要的启迪。这项工作投稿后获得了编辑和审稿人的高度评价,有审稿人认为“This manuscript significantly advances the field”,还被主编选为“Breakthrough Article”(Nucleic Acids Research每年仅有约2%的文章被选为“Breakthrough Article”)。
复旦大学生物医学研究院/附属上海市第五人民医院的双聘PI胡晋川是论文的通讯作者,复旦大学生物医学研究院博士研究生谈远清和高孟为论文的共同第一作者。本研究获得了复旦大学附属肿瘤医院/生物医学研究院徐彦辉研究员和中科院分子细胞卓越中心孟飞龙研究员的大力支持,以及科技部重点研发计划和国家自然科学基金面上项目等资助。
值得注意的是,在本论文投稿和发布到预印本平台bioRxiv后,有三篇类似的研究也发布在bioRxiv上【3-5】。这三项来自不同合作团队的工作都发现STK19是TCR的必须因子,并用冷冻电镜解析了包含STK19的TCR上游复合物结构,实际观测到的复合物结构与AlphaFold预测的结构非常相似。
原文链接:https://doi.org/10.1093/nar/gkae787
参考文献:
1.Boeing, S., Williamson, L., Encheva, V., Gori, I., Saunders, R.E., Instrell, R., Aygün, O., Rodriguez-Martinez, M., Weems, J.C., Kelly, G.P., et al. (2016). Multiomic Analysis of the UV-Induced DNA Damage Response. Cell Reports 15, 1597-1610. 10.1016/j.celrep.2016.04.047.
2.Olivieri, M., Cho, T., Alvarez-Quilon, A., Li, K., Schellenberg, M.J., Zimmermann, M., Hustedt, N., Rossi, S.E., Adam, S., Melo, H., et al. (2020). A Genetic Map of the Response to DNA Damage in Human Cells. Cell 182, 481-496 e421. 10.1016/j.cell.2020.05.040.
3.Mevissen, T.E.T., Kummecke, M., Schmid, E.W., Farnung, L., and Walter, J.C. (2024). STK19 positions TFIIH for cell-free transcription-coupled DNA repair. bioRxiv. 10.1101/2024.07.22.604623.
4.van den Heuvel, D., Rodriguez-Martinez, M., van der Meer, P.J., Moreno, N.N., Park, J., Kim, H.S., van Schie, J.J.M., Wondergem, A.P., D'Souza, A., Yakoub, G., et al. (2024). STK19 facilitates the clearance of lesion-stalled RNAPII during transcription-coupled DNA repair. bioRxiv. 10.1101/2024.07.22.604575.
5.Ramadhin, A.R., Lee, S.-H., Zhou, D., Salmazo, A., Gonzalo-Hansen, C., van Sluis, M., Blom, C.M.A., Janssens, R.C., Raams, A., Dekkers, D., et al. (2024). STK19 drives Transcription-Coupled Repair by stimulating repair complex stability, Pol II ubiquitylation and TFIIH recruitment. bioRxiv. 10.1101/2024.07.22.604556.