Science Advances丨叶丹团队揭示CEBPA是DNMT3A的特异性抑制因子
在急性髓系白血病(AML)中,~40%的基因突变与DNA甲基化修饰相关,包括DNA甲基转移酶DNMT、DNA羟甲基化酶TET2、代谢酶IDH、转录因子等,这为研究基因组特定区域的DNA甲基化调控提供了理想的疾病模型。基因组特定区域的DNA甲基化不可能仅由DNA序列CpG位点决定,而是表观修饰酶与识别DNA的转录调控因子协同作用的结果。在前期研究中,叶丹团队曾报道招募TET2的首个转录因子WT1,发现WT1与TET2蛋白互作和形成复合物,将TET2募集到WT1靶基因启动子区域,调控WNT等癌症信号通路和抑制AML细胞增殖。还证实AML来源TET2或WT1突变,或IDH突变所产生致癌代谢物D-2-HG抑制了TET2活性,三种情况均产生相同效应,即导致WT1-TET2复合物无法促进靶基因启动子区DNA去甲基化,这为“在AML中IDH、TET2与WT1基因突变存在互斥”遗传现象提供了分子机制解释(Mol Cell. 2015)【1】。随后,叶丹团队相继报道了除WT1之外的一批与TET2蛋白相互作用的转录调节因子,鉴定出招募TET2的首个转录共激活子SNIP1(Cell Reports, 2018)【2】、首个蛋白结构域SCAN(Cell Reports, 2020)【3】。那么,负责DNA甲基化建立的表观修饰酶,如DNA甲基转移酶DNMT等,它们在基因组特定区域如何调控DNA甲基化和靶基因表达?目前并不清楚。
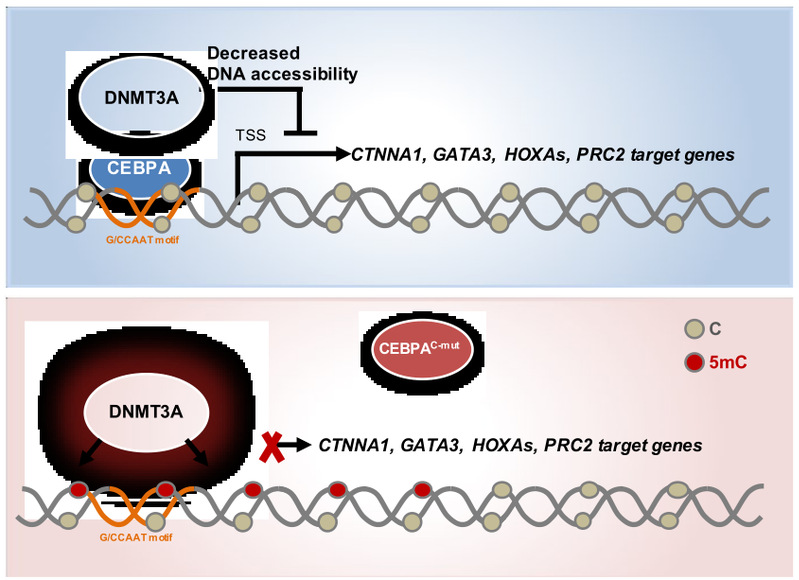
2022年1月26日,我院叶丹团队在Science Advances上发表题为Tumor suppressor CEBPA interacts with and inhibits DNMT3A activity研究成果,首次报道了CEBPA是DNMT3A的特异性抑制因子。

CEBPA是在粒细胞分化过程中起关键作用在转录因子。在AML中CEBPA突变率为7~11%,并且CEBPA突变AML患者基因组DNA存在CpG高甲基化现象【4】。通过筛选与DNA甲基化相关表观修饰酶形成复合物,发现了CEBPA与DNMT3A长剪切异构体之间存在特异性结合,并鉴定出CEBPA的C末端碱性亮氨酸拉链结构域bZIP介导其与DNMT3A结合。体外实验显示,该结合发生在DNMT3A蛋白N末端,显著降低了甲基转移酶DNMT3A对底物DNA的亲和能力,从而抑制DNA甲基转移酶活性。在培养细胞和动物模型中,还发现AML来源CEBPA突变能破坏CEBPA-DNMT3A复合物形成和解除对DNMT3A抑制效应,导致CEBPA突变AML细胞的基因组DNA高度甲基化和PRC2靶基因表达下调,并且对临床已用的DNMT抑制剂(DNMTi)靶向药物尤为敏感。简言之,该工作首次报道了CEBPA是DNMT3A的特异性抑制因子,揭示了在基因组特定区域DNMT3A调控新机理,并为携带CEBPA突变的白血病患者临床治疗提供了潜在方案。
复旦大学生物医学研究院2013级博士生陈修斐(现为牛津大学Ludwig肿瘤研究所博士后)、2016级博士生周文捷,悉尼大学Renhua Song博士和南京大学模式动物研究所2021级博士生刘爽,为本文共同第一作者。复旦大学生物医学研究院叶丹研究员、南京大学模式动物研究所李颜教授、复旦大学附属华山医院陈彤教授为共同通讯作者。该工作得到了复旦大学附属华山医院青年研究员杨辉和悉尼大学Justin Jong-Leong Wong教授的合作支持。
原文链接:http://doi.org/10.1126/sciadv.abl5220
参考文献
Wang, Y., et al., WT1 recruits TET2 to regulate its target gene expression and suppress leukemia cell proliferation.Mol Cell, 2015. 57(4): p. 662-673.
Chen, L., et al., SNIP1 Recruits TET2 to Regulate c-MYC Target Genes and Cellular DNA Damage Response. Cell Reports, 2018. 25(6): p.1485-1500.
Cheng, Z., et al., The Zscan4-Tet2 Transcription Nexus Regulates Metabolic Rewiring and Enhances Proteostasis to Promote Reprogramming. Cell Reports, 2020. 32(2): 107877.
Sinha, S., et al., Mutant WT1 is associated with DNA hypermethylation of PRC2 targets in AML and responds to EZH2 inhibition.Blood, 2015. 125(2): p. 316-26.