复旦学者首次成功解析哺乳动物TET蛋白三维结构——或为找到抗血液肿瘤药物提供“导航”
新闻中心讯 复旦大学生物医学研究院、附属肿瘤医院研究员徐彦辉带领其课题组成员胡璐璐、李泽和程净东等,经4年多潜心研究,首次成功解析了哺乳动物骨髓造血关键蛋白TET2的三维结构,该成果对研究多种疾病的发病机制,尤其对血液肿瘤(如髓系白血病)治疗性药物开发有重大意义。该成果12月6日已在线发表在国际顶级学术期刊《细胞》杂志上,引起世界同行广泛关注。
哺乳动物TET蛋白家族有3个成员,即TET1蛋白、TET2蛋白和TET3蛋白。TET蛋白在哺乳动物发育和骨髓造血等关键生命过程中扮演着至关重要的角色,如果TET蛋白失去活性(丧失功能)的话,就会导致各种疾病的发生,尤其会罹患血液肿瘤。人体遗传物质DNA上有一种甲基化特殊标记,该标记对哺乳动物发育和癌症发生有重要的作用。在正常情况下, 甲基化标记位点排列正确的话,生命运动运转正常,但如果标记位点紊乱,就会导致各种疾病,尤其是血液肿瘤疾病发生。有趣的是,哺乳动物在发育过程中的各阶段,体内会根据需要自动调节(去除或添加) DNA上的甲基化标记。科学界对甲基化标记是如何被“添加”到DNA上的这一过程,已有定论,但对甲基化标记是如何被“去除”的机制一直困扰着科学界,成为世界之谜。直至2009年,有科学家经研究发现,原来哺乳动物体内的TET蛋白对甲基化标记的“去除”起关键作用,也就是说,TET蛋白会在甲基化标记上再逐步添加“羟基,醛基,直至羧基化标记”,于是便出现了两个标记被一并去除、仅剩下未被标记的DNA而完成DNA去甲基化的过程。
而2009年前,TET蛋白在生命运动中分别担任什么角色、有何作用搞不清楚。
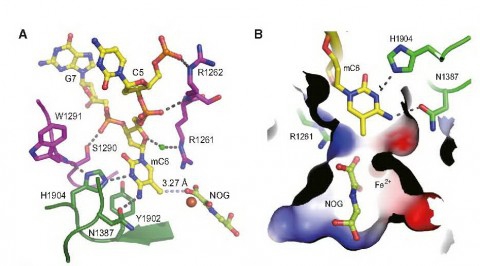
2009年DNA甲基化标记被“去除”机制揭晓后,科学界对羟基,醛基和羧基化标记是如何被TET蛋白“添加”到DNA上去的产生浓厚兴趣,该难题成为新的世界之谜。四年多前,徐彦辉课题组也开展了对这一“热点”的追踪研究,经艰辛攻关,最终他们运用X射线晶体学等研究方法,获得了TET2蛋白和DNA两者结合在一起的三维结构,结果发现TET2蛋白非常“聪明”,它能够自动识别、找到甲基化标记,并会把甲基化标记修饰过的DNA“翻转”到TET2蛋白的内部,又在内部铁离子等帮助下,产生氧化反应后,将这些标记逐步“添加”到DNA甲基化标记上。
研究发现, TET1蛋白在急性髓细胞性白血病中与致癌蛋白MLL发生融合后会导致哺乳动物罹患癌症,后来研究又发现血液肿瘤患者血液中含有多种TET2蛋白突变,且突变率很高,正是这些突变影响了TET2蛋白的活性,导致它“消极怠工”,无所作为,最终引起疾病发生。而TET2蛋白的“同胞兄弟”TET1在急性髓细胞性白血病形成过程中“过分活跃”,扮演了“致病帮凶”的角色。徐彦辉课题组研究成果的重大意义在于:下一步的研究可以通过对TET2蛋白三维结构的分析、计算机模拟、高通量的化合物筛选等方法,找到能够激活TET2蛋白,或抑制TET1蛋白活性的相关药物,从而为人类最终战胜白血病等作出贡献。
据悉, 2009年以来,全球至少有数十家著名研究机构都在研究TET蛋白的三维结构,以求有所突破,但始终未有结果,而徐彦辉课题组的成果及时、有效地填补了这一空白。
作者:孙国根