Mol Cell|陈飞团队揭示转录早期终止调控复合物INTAC对转录机器命运决定的调控机制
高等动物中RNA聚合酶II (Pol II)介导的转录是一个高度协调的过程,涉及转录起始、启动子近端暂停、延伸和终止之间的动态转变。在转录起始不久之后,Pol II会在转录起始位点(TSSs)下游200 bp的窗口内暂停。在停留不同的时间后,Pol II将走向两个命运:继续延伸或启动子近端终止。由于Pol II延伸和启动子近端终止的选择会导致基因表达水平出现不同甚至相反的结果,因此控制暂停Pol II命运的因子对塑造转录全景至关重要。
目前发现,Pol II从暂停位点释放到延伸过程主要由P-TEFb驱动(1),而启动子近端终止则很大程度上是受到INTAC复合体的调节(2)。
多亚基蛋白复合物INTAC由Integrator和PP2A两个酶活模块组成,分别催化RNA切割和蛋白质去磷酸化(图1)。但这两个酶活模块在转录调控中分别具备什么功能,又是如何协作的,仍不十分清楚。
INTAC中的Integrator的RNA内切酶活性最初被发现可调节小核RNA(snRNA)的转录终止,近年来研究发现它也广泛作用于其他种类的RNA,如蛋白质编码基因、启动子上游转录物和增强子RNA。然而,Integrator虽然可结合绝大多数激活的启动子,但其RNA内切酶活性缺失导致表达受影响的基因数量却非常有限。此外,Integrator或INTAC介导的启动子近端终止的作用存在两种模型:它既有可能通过去除无延伸能力的Pol II来促进转录激活、为新启动的聚合酶扫清道路;也有可能靶向有延伸能力的Pol II来抑制基因表达,从而终止转录。到底哪种模型更为主要,不同转录活性的基因是否偏好不同的模型,仍不清楚。
INTAC中的PP2A磷酸酶模块可以催化Pol II CTD以及转录延伸因子SPT5的去磷酸化。同时,该磷酸酶模块能够和PAF1协同调控转录的暂停释放。高分辨率Cryo-EM结构表明这两种模块分别位于复合物骨架的相对侧,因此两个催化模块可能独立发挥作用。
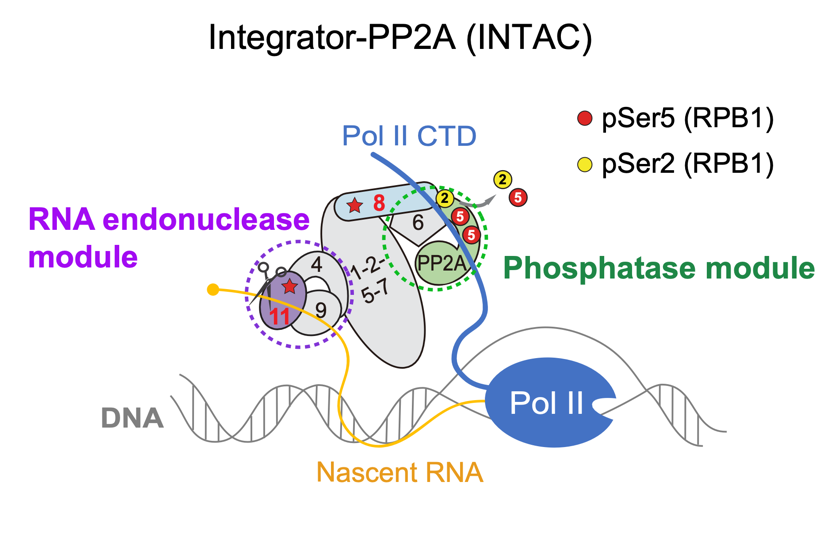
图1. Integrator-PP2A(INTAC)复合物RNA内切酶模块(INTS4-INTS9-INTS11)和磷酸酶模块(INTS6-PP2A)示意图。
2023年4月19日,复旦大学生物医学研究院陈飞团队在Molecular Cell上发表了研究论文INTAC endonuclease and phosphatase modules differentially regulate transcription by RNA polymerase II,揭示了INTAC复合物的RNA内切酶和磷酸酶两个功能模块在转录调控中扮演了不同的角色。

为了研究INTAC的RNA内切酶(核心亚基INTS11)的功能,作者首先在人结直肠癌细胞系DLD-1中构建INTS11的dTAG蛋白快速降解细胞系(INTS11-dTAG)。通过多组学实验发现,INTS11的缺失
影响INTAC磷酸酶模块,说明INTS11的缺失能特异性影响RNA内切酶功能。INTS11的缺失会导致Pol II信号在所有的活跃基因上向暂停位点的下游转移(图2A-C),且在启动子上的总结合量上升,说明INTAC的RNA内切酶对启动子近端终止的广泛调节作用(图2D)。

图2. INTS11快速降解后,Pol II向暂停位点的下游转移(A-C),且在启动子的总结合量上升(D)。
INTAC内切酶活性如何影响基因表达尚存争议。本文作者发现,INTAC的RNA内切酶模块(INTS11)的缺失对不同类型基因的表达有着不同的影响:高表达基因转录下调,而低表达基因和非编码元件转录上调(图3)。但无论是高表达还是低表达基因,作者发现INTS11降解均会导致Pol II在启动子近端积累,而对表达量的影响却相反。作者猜测这可能是因为低表达启动子的转录频率低、RNA内切酶底物少,因此无论Pol II是否具备转录延伸活性,INTS11均可使其启动子近端终止,所以INTS11降解导致转录活性上升;而对于转录频率较高的高表达启动子,INTS11底物过多,可能优先靶向不具备延伸活性的Pol II,因此INTS11降解导致转录活性下降。

图3. INTS11快速降解后,新生RNA表达水平变化
为了研究INTAC的磷酸酶模块,作者通过在DLD-1细胞中构建INTS8的dTAG快速降解系统并表达INTS8氨基端截短体(INTS8-dTAG+ΔN),以阻止PP2A与Integrator的结合,同时不影响INTAC的整体稳定性,从而实现了特异性干扰INTAC的磷酸酶功能而不影响RNA内切酶模块。利用该系统,作者发现磷酸酶模块的缺失会导致所有的活跃基因上RNA Pol II的磷酸化水平上调,说明该模块是细胞内最主要的RNA Pol II磷酸酶。另外,作者发现,INTAC磷酸酶功能与RNA内切酶模块对转录的调控功能不同:磷酸酶缺失主要导致基因(尤其是高度暂停的基因)转录暂停的释放,并引起这些基因的表达上调。(图4)
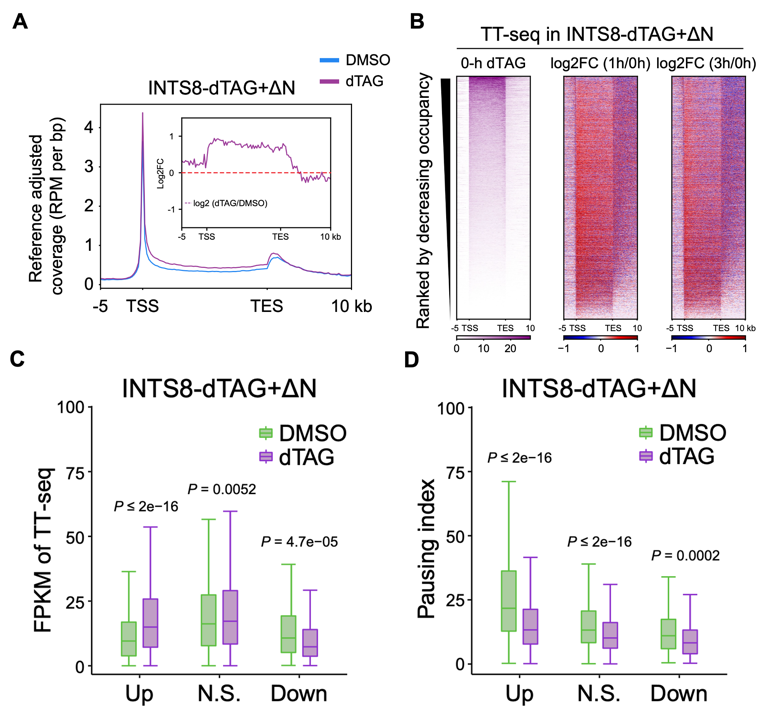
图4. INTS8快速降解同时表达INTS8-ΔN,基因上Pol II的水平变化(A)和新生RNA的表达变化(B),以及新生RNA表达差异基因的表达量(C)和暂停程度(D)
综上所述,作者利用精妙的实验设计,很好地将INTAC的两个催化模块区分开进行研究,发现INTAC的RNA内切酶和磷酸酶模块在转录调控中具有广泛但不同的作用。即RNA内切酶模块切割新生RNA,介导了启动子近端暂停的RNA Pol II的转录启动子近端终止;而磷酸酶模块则主要是去磷酸化RNA Pol II,抑制RNA Pol II从暂停位点释放,从而降低转录水平。该研究为将来进一步认识和研究转录调控过程提供理论基础。未来作者将进一步研究INTAC的两个催化模块如何协同调控转录。

复旦大学附属肿瘤医院助理研究员胡士斌、博士后彭林娜、复旦大学生物医学研究院博士生宋爱霞、直博生籍雨鑫为本文共同第一作者,复旦大学陈飞研究员为本文通讯作者。
原文链接:https://doi.org/10.1016/j.molcel.2023.03.022
参考文献:
1.Chen, F.X., Smith, E.R., and Shilatifard, A. (2018). Born to run: control of transcription elongation by RNA polymerase II. Nat Rev Mol Cell Biol 19, 464-478. 10.1038/s41580-018-0010-5.
2.Zheng, H., Qi, Y., Hu, S., Cao, X., Xu, C., Yin, Z., Chen, X., Li, Y., Liu, W., Li, J., et al. (2020). Identification of Integrator-PP2A complex (INTAC), an RNA polymerase II phosphatase. Science 370. 10.1126/science.abb5872.