JACS | 顾宏周团队发现特异紧密结合过渡态金属离子的DNA
金属离子与DNA的可溶性和稳定性密切相关。大量“离子-DNA互作”的研究不仅揭示了金属离子在人类健康及疾病发展中扮演的角色,而且为一系列离子作用的生物技术的开发奠定了基础。然而,能特异紧密结合金属离子的DNA种类较少,限制了基于金属离子-DNA互作的生物技术的进一步发展。
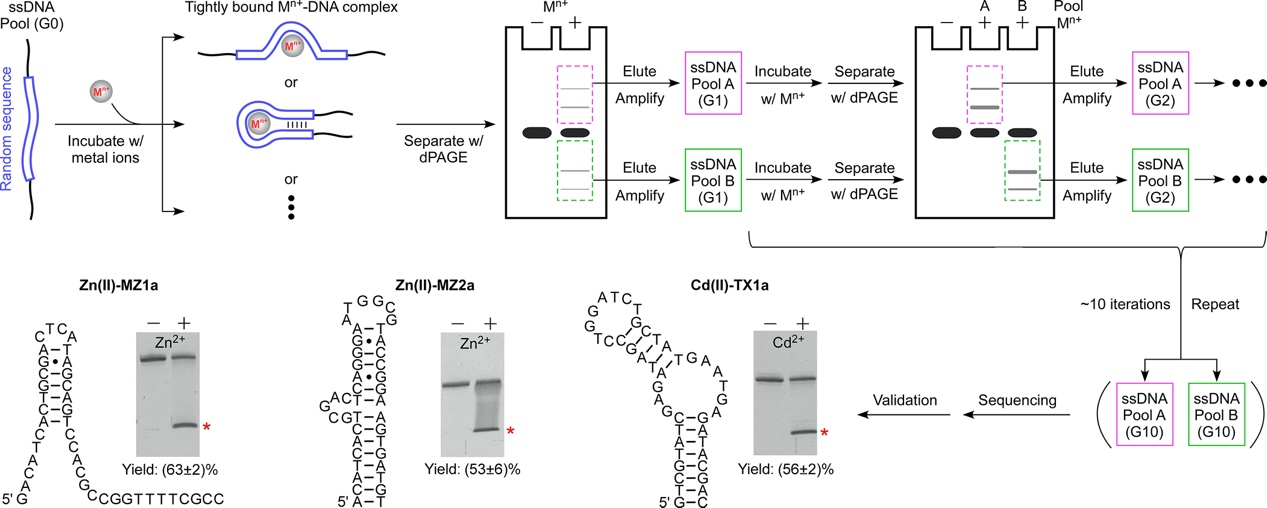
2023年4月13日,复旦大学生物医学研究院顾宏周(现任职于上海交通大学)团队在Journal of the American Chemical Society期刊上发表题为“Small DNAs that specifically and tightly bind transition metal ions”的工作,通过开发一种新型试管内筛选进化策略,发现了一系列短链DNA片段可选择性稳定结合Zn2+或Cd2+等过渡态金属离子,并展示了此类DNA作为离子载体在定向递送上的潜力。

在这项工作中,研究者基于紧密结合金属离子后的DNA在变性凝胶电泳中迁移率产生变化,提出了一种简易的筛选策略,用于分离鉴定与任意金属离子特异结合的DNA序列。以Zn2+和Cd2+为例,研究者通过筛选分别获得了Zn2+特异性和Cd2+特异性结合的DNA,证明了该筛选策略的可行性和通用性。有意思的是,这些新发现的离子特异结合型DNA仅包含40-45个碱基,一旦结合了相应的金属离子后,复合物甚至可以耐受8 M尿素和50 mM EDTA的极强变性条件。尽管此类“DNA-金属离子”的紧密结合机制尚不清楚,这些发现仍然为诸如离子的定向运输等应用奠定了基础。
在生命体内,过渡态金属离子,包括Zn2+,控制着一系列重要的生理过程。然而,超过一定的浓度水平,过渡态金属离子对细胞具备很强毒性。这一点原则上可被用来开发基于金属离子的药物疗法(如用于化疗的铂类药物),但由于缺乏靶向递送金属离子的有效手段,该疗法通常副作用很大,难以推广应用。作为新递送方式的一种展示,研究者基于获得的Zn2+结合型DNA,构建了一套DNA复合系统(SZ),可特异性地携带Zn2+并靶向进入特定白血病细胞(CCRF-CEM),在低副作用的前提下,依靠靶向递送的Zn2+的毒性高效地杀死特定细胞。这些结果表明,能特异紧密结合过渡态金属离子的DNA作为一种可靠的载体,在基于金属离子的靶向药物开发中具有巨大潜力。

综上,本研究建立了一套新的体外筛选进化策略,揭示了一类新的与过渡态金属离子特异紧密结合的DNA。该工作不仅拓展了我们对“金属离子-DNA互作”的认知,而且为基于金属离子的靶向药物疗法提供了潜在的新工具。
复旦大学2019级直博生周末和2018级硕士生许田斌为本文的共同第一作者,夏凯、高海清、李薇和翟婷婷对本文也有重要的贡献,生物医学研究院顾宏周研究员(现任上海交通大学化学化工学院研究员)为本文的通讯作者。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.3c01276