诺奖解读讲座回顾:肿瘤免疫治疗那点事
2018年10月17日晚6:30,应复旦大学生物医学研究院(IBS)研究生团学联之邀,上海市免疫学研究所李斌研究员做客复旦大学枫林校区,为同学们解读2018年诺贝尔生理学或医学奖——肿瘤免疫治疗。何为肿瘤免疫治疗?肿瘤免疫治疗的工作原理是什么?已经取得了哪些阶段性成果?还有哪些挑战?
我们的身体每时每刻都面临着“内忧外患”。“外患”是指各种外来的病原体,包括细菌、病毒等;而“内忧”则指机体内部产生的有害物质,包括细胞代谢废物、细胞碎片以及叛变的细胞——肿瘤细胞等。我们人体就像是一座城池,面对各种入侵和内乱,大部分情况下安然无恙,这得益于这座城池的三道防线,由皮肤和黏膜组成的第一道防线,由先天免疫组成的第二道防线,这两道防线可以阻隔绝大多数外来的病原体;一旦病原体突破了这两道防线,已兵临城下,我们的机体将启动第三道防线——由 T 淋巴细胞和 B 淋巴细胞为核心的获得性免疫。
而在解决“内忧”方面,尤其是清除肿瘤细胞方面,T 淋巴细胞是主力军。T淋巴细胞就像在城中巡逻的士兵,一旦发现异常居民,立即采取行动,将叛变扼杀在摇篮中。在机体内,这是通过亿万年的进化,细胞之间形成的一种默契,异常的细胞会释放“我是异常细胞”的信号,T细胞则能发现并阅读这些信号,启动清除异常细胞的程序,这种进化机制保证了机体的正常运行。
但为何T细胞对肿瘤细胞视而不见呢?原来狡猾的肿瘤细胞一方面懂得伪装自己,另一方面,肿瘤细胞可以抑制免疫系统,进而逃避免疫系统的监视和捕杀,也就是说,肿瘤细胞既可以蒙蔽T细胞的“双眼”,又可以降低T细胞的“战斗力”。针对肿瘤细胞的这两个特性,科学家们开发了肿瘤免疫治疗,其基本策略是借助自身的免疫系统清除细胞,主要包括细胞治疗和免疫检查点抑制剂。细胞治疗的策略是将肿瘤细胞的特征“告诉”免疫细胞,让免疫细胞精准靶向肿瘤细胞,比如正在如火如荼进行的CAR-T治疗,其基本操作是分离肿瘤患者体内的T细胞,在体外进行人工改造(使T细胞特异性识别肿瘤细胞)并大量扩增,改造后的细胞重新输入体内,从而实现靶向清除肿瘤细胞的目的。免疫检查点是指肿瘤细胞会抑制免疫系统,免疫检查点抑制剂的策略是通过药物解除这种抑制作用,使得免疫细胞正常工作,进而清除肿瘤细胞。
回顾往昔,肿瘤免疫治疗走过了一段不平凡的历程。
科学家们在研究T细胞时,在被激活的T细胞表面发现了一种名为细胞毒性T淋巴细胞相关抗原CTLA-4(cytotoxic T lymphocyte associated antigen 4, CTLA-4)的蛋白。1987年,皮埃尔·格林斯(Pierre Golstain)实验室克隆出CTLA-4基因,1994年和1995年,杰弗里·布鲁斯通(Jeffrey A. Bluestone)和詹姆斯·艾利森(James P. Allison)分别报道CTLA-4能抑制T细胞活化。负负得正,是否能够通过抑制CTLA-4来激活T细胞呢?1995年,加拿大著名华人科学家麦德华(Tak Wah Mak)团队和美国免疫学家阿琳·夏普(Arlene Sharpe)团队报道CTLA-4基因敲除小鼠患有严重的自体免疫疾病。自身免疫性疾病是免疫系统过度激活的体现,因此这两个结果进一步证明了CTLA-4确实是T细胞的负向调控因子。1996年,艾利森报道CTLA-4抗体(CTLA-4抗体的作用是与CTLA结合,阻断正常的CTLA-4通路,进而起到抑制的作用,后文提到的抗体作用机制类似)可以激活肿瘤免疫并清除小鼠体内的肿瘤。但是由于CTLA-4敲除小鼠会产生严重的自身免疫反应,这让制药公司打了退堂鼓。但艾利森却没有放弃,他成功游说了生物公司Medarex。2000年,Medarex制造出了CTLA-4单克隆抗体——伊匹单抗(ipilimumab)。2010年,伊匹单抗的Ⅲ期临床试验结果公布,对于晚期黑色素瘤病人,伊匹单抗可延长病人存活时间约3~4个月。2011年,美国食品药品监督管理局(FDA)批准伊匹抗体可用于治疗晚期黑色素瘤,这是第一个获批的肿瘤免疫疗法。
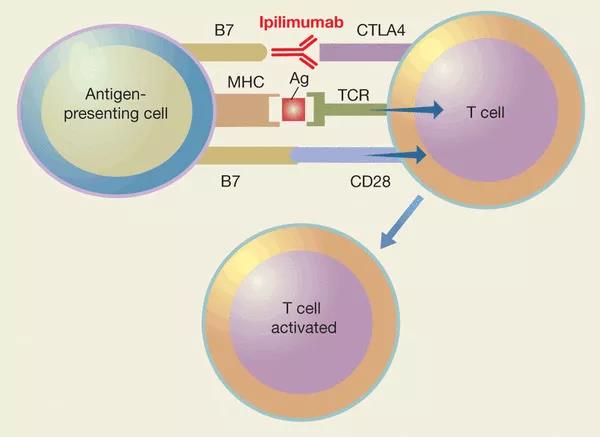
图1. CTLA-4抗体的工作机制
(Antigen-presenting cell, 抗原呈递细胞;Ag,抗原;TCR,T细胞受体)
图片来源:http://www.nzmu.co.nz/anti-ctla-4-inhibitors
除了CTLA-4,T细胞发挥其免疫功能还跟其表面另一个关键的蛋白PD-1紧密相关。1992年,本庶佑团队首次在T细胞中发现并克隆了PD-1。该基因在凋亡细胞中表达,因此得名程序凋亡蛋白(Programmed cell death 1)。本庶佑进一步研究发现PD-1敲除的小鼠自身免疫性疾病比较微弱,这提示PD-1是类似于CTLA-4的免疫负向调控因子。但PD-1如何发挥作用呢?这就需要鉴定PD-1与哪些因子相互作用。1999年,华人科学家陈列平首次克隆了B7-H1基因,并发现B7-H1可以诱导T细胞死亡。2000年,本庶佑鉴定了PD-1的配体PD-L1(而PD-L1正是此前陈列平教授鉴定的B7-H1),并发现PD-1和PD-L1的结合可导致免疫抑制。2002年,陈列平首次报道了PD-L1在多种肿瘤细胞中高表达,而且肿瘤细胞中过表达的PD-L1可以抑制T细胞的功能,并发现在小鼠中,PD-L1抗体可抑制肿瘤生长。
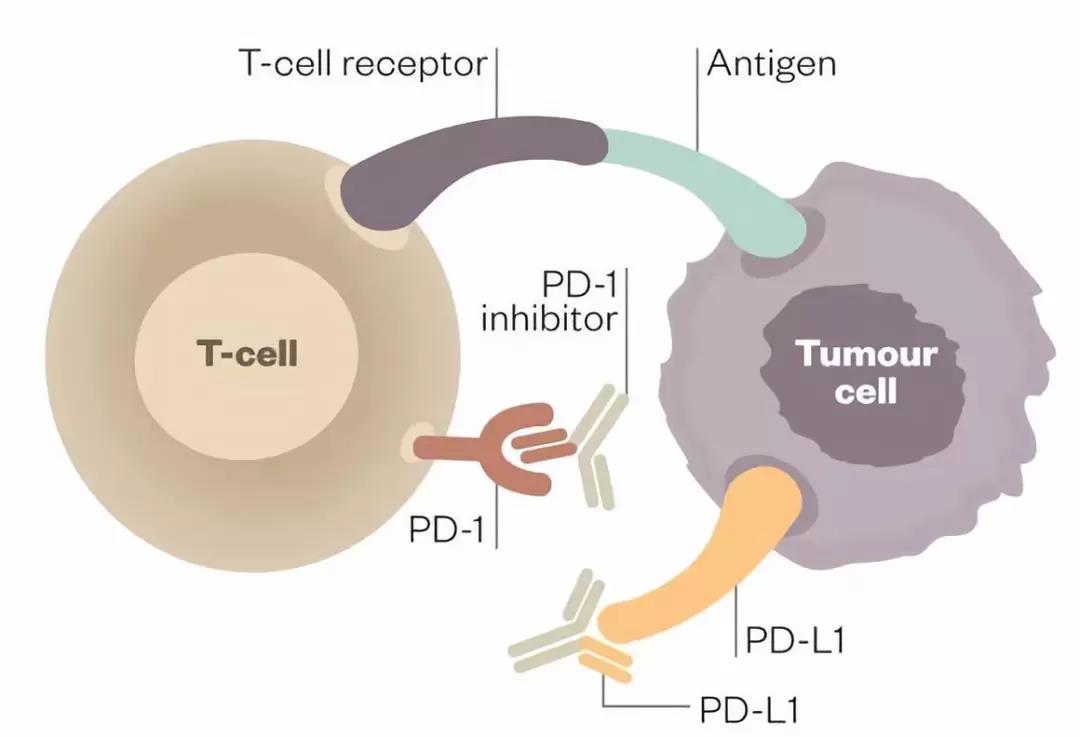
图2. PD-1抗体和PD-L1抗体的工作机制
图片来源:https://labiotech.eu/medical/hiv-treatment-repurposed-drug-france/
至此,整个故事基本上串联起来:肿瘤细胞高表达PD-L1,PD-L1与T细胞表面的PD-1结合,进而抑制了T细胞的功能。因此,只需要阻断PD-L1和PD-1的结合,就可以解除肿瘤细胞对免疫细胞的抑制作用,使得T细胞可以正常杀伤肿瘤细胞。本庶佑带领团队与制药公司开展合作;2014年PD1抑制剂纳武单抗OPDIVO(Nivolumab)在日本获批,用于转移黑色素瘤和转移鳞状非小细胞肺癌。相比于CTLA-4单抗,纳武单抗的副作用小,因此被寄予厚望。

图3. 詹姆斯·艾利森(James P. Allison)和本庶佑(Tasuku Honjo)
图片来源:https://www.icr.ac.uk/blogs/science-talk-the-icr-blog/page-details/nobel-prize-for-medicine-2018-the-early-research-that-led-to-revolutionary-cancer-immunotherapy
肿瘤免疫治疗是人类对抗肿瘤征程上的一座里程碑。2018年诺贝尔生理学或医学奖颁发给了美国免疫学家詹姆斯·艾利森(James P. Allison)和日本免疫学家本庶佑(Tasuku Honjo)。获奖理由为他们通过抑制负向免疫调控,发现了新的癌症治疗方法。而值得一提的是,2017年“复旦——中植科学奖”同样授予了上述两位科学家。
诺奖已经落下帷幕,科学的征程却从来不会停止。首先,目前获批的肿瘤免疫治疗药物只适用于特定的几种肿瘤,如何扩大药物的适用范围,开发更多的新药,让更多肿瘤患者受益;其次,目前的治疗方案或多或少具有副作用,如何进一步降低副作用,提高患者的生存期和生活质量;最后,我们真的已经研究透彻肿瘤是什么,肿瘤怎么发生发展,怎么转移和复发吗?路漫漫其修远兮,上下求索之。
参考资料:
1. 科学网:http://news.sciencenet.cn/htmlnews/2017/2/368755.shtm
2. 知识分子:《日本科学家又获诺奖:清华董晨评论》
3. 知识分子:《2018诺贝尔生理或医学奖给错人了吗?| 分析批判》