Nature Communications | 杨力团队发现肿瘤高表达环形RNA-circMAN1A2(2,3,4,5)调控结直肠癌发展的分子机制
真核生物前体RNA通过反向剪接产生环形RNA(circRNAs),而可变环化可以从一个基因位点产生多个不同的环形RNA,丰富了环形RNA转录组的复杂性,并拓展了其功能的多样性。
2025年9月29日,复旦大学生物医学研究院杨力研究组在Nature communications杂志在线发表了题为“Direct circMAN1A2(2,3,4,5)-CENPB mRNA interaction regulates cell proliferation and cancer progression”的研究论文,报道了一种可变环化产生的环形RNA-circMAN1A2(2,3,4,5)在肿瘤样本中的高表达,并揭示其通过RNA-RNA互作参与调控结直肠癌发展的机制。

该研究首先在多种细胞和组织中系统描绘了circRNAs的可变环化表达谱,在每个可变环化的基因位点鉴定到了一个主要表达的环形RNA (predominantly expressed circular RNAs, pe-circRNAs)。通过比较正常和结直肠癌组织中pe-circRNAs的表达,研究发现MAN1A2基因位点产生的pe-circMAN1A2(2,3,4,5)在结直肠癌组织中显著高表达,而其在其它癌种样本中的广谱性高表达提示其功能的重要性。后续功能研究发现,敲低circMAN1A2(2,3,4,5)导致着丝粒相关蛋白CENPB的下调,进而引起染色质不稳定和细胞周期阻滞、并抑制结直肠癌细胞增殖。进一步的小鼠皮下和原位结直肠癌模型也表明敲低circMAN1A2(2,3,4,5)可抑制结直肠癌的发展。深入的机制研究发现,circMAN1A2(2,3,4,5)一方面与影响mRNA稳定性相关的IGF2BP2蛋白有直接相互作用,另一方面也通过其特征的反向剪接(back-splicing junction, BSJ)位点序列与CENPB mRNA的3'非翻译区直接结合,进而增强IGF2BP2介导的CENPB mRNA的稳定性,促进直肠癌的发展。因此,在小鼠皮下模型中利用锁核苷酸靶向circMAN1A2(2,3,4,5) BSJ位点可封闭circMAN1A2(2,3,4,5)- CENPB mRNA的直接相互作用,并抑制肿瘤的生长。
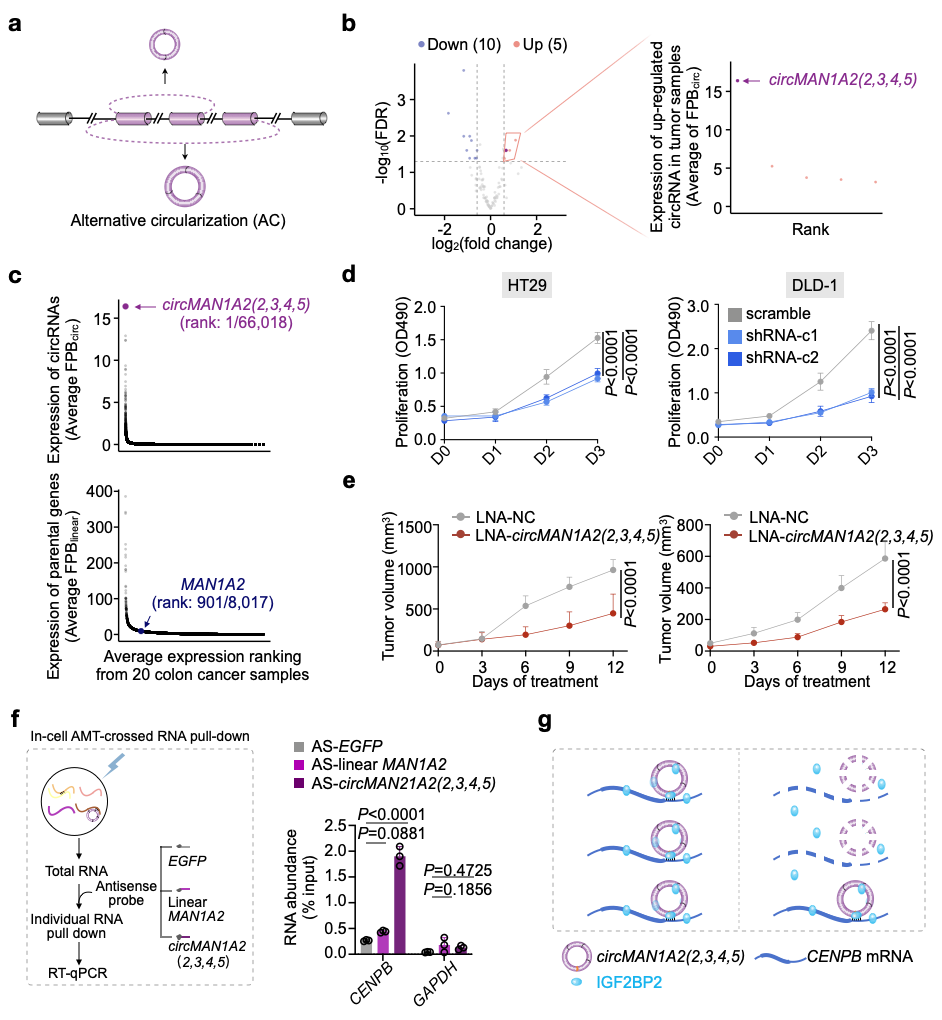
综上,该研究系统描绘了细胞和组织中可变环化的全景图谱,阐明了可变环化产生的pe-circRNA在肿瘤发生发展过程中的重要角色,为利用环形RNA作为分子靶标治疗相关肿瘤疾病提供了新的思路和理论基础。
复旦大学生物医学研究院助理研究员曹梅、中国科学院上海营养与健康研究所博士研究生袁国华、中国科学院分子细胞科学卓越创新中心博士后曹诗梦为该论文共同第一作者,杨力研究员为该论文的通讯作者。该研究得到了中国科学院分子细胞科学卓越创新中心陈玲玲研究员的大力支持和悉心指导。该工作获得国家重点研发计划、国家自然科学基金、中国科学院青年基础研究项目、上海市科学技术委员会等的项目资助。
原文链接:https://www.nature.com/articles/s41467-025-63686-7