周玉峰团队揭示长非编码RNA调控巨噬细胞活化和炎症性疾病的新机制
巨噬细胞作为一种初始免疫细胞,是机体炎症反应的重要参与和调节者。巨噬细胞具有明显的异质性和可塑性,在不同的环境条件下可以分化为经典激活(classically activated)的M1型和替代激活(alternatively activated)的M2型两种功能截然不同的亚型。M1型巨噬细胞主要由LPS、IFN-γ等激活,可诱导Th1细胞反应,主要参与抗感染免疫应答,并引起炎症损伤。M2型巨噬细胞主要由IL-4、IL-13、IL-10等激活,可诱导Th2细胞反应,与过敏性哮喘的发生发展相关;另外M2型巨噬细胞还可发挥调节性或抑制性效应对抗炎症反应,参与组织修复功能。然而,M2型巨噬细胞激活的调控机制尚未完全清楚,尤其是长非编码RNA(lncRNA)在其中的作用还知之甚少。
12月11日,我院周玉峰课题组在Science Advances上发表题为LncRNA PTPRE-AS1 modulates M2 macrophage activation and inflammatory diseases by epigenetic promotion of PTPRE 的文章,揭示了长非编码RNA调控M2型巨噬细胞活化和炎症性疾病的新机制。

研究人员发现: (1)lncRNAs PTPRE-AS1 选择性地在IL-4激活的M2型巨噬细胞中高表达;(2)在骨髓来源的巨噬细胞和巨噬细胞系RAW264.7中,敲低PTPRE-AS1的表达可显著促进M2型巨噬细胞相关基因IL-10和CD206等的表达,而过表达PTPRE-AS1则抑制M2型巨噬细胞相关基因的表达,表明PTPRE-AS1抑制M2型巨噬细胞活化;(3)随后研究发现PTPRE-AS1可以通过顺式调控作用促进其相邻基因PTPRE的生成。而PTPRE基因,作为一种蛋白酪氨酸磷酸酶,参与负向调控MAPK/ERK 1/2 信号通路的激活,从而影响下游M2型巨噬细胞相关基因的表达;(4)在机制研究上,通过核质定位、RIP和RNA-pull down 等方法发现PTPRE-AS1可以与H3K4me3转移酶复合物的关键成分WDR5蛋白结合,通过增加PTPRE基因启动子区域的H3K4me3水平从而激活其转录;(5)随后,作者构建了PTPRE-AS1基因敲除小鼠,发现在DSS诱导的以M1巨噬细胞过度活化为特征的炎症性肠炎小鼠模型中,PTPRE-AS1敲除小鼠M2型巨噬细胞活化增强,肠炎病情得以缓解;然而在蟑螂过敏原诱导的过敏性哮喘小鼠模型中,PTPRE-AS1敲除小鼠肺组织中的M2型巨噬细胞过度激活却加重肺部炎症;(6)在儿童过敏性哮喘的外周血单核细胞样本中,发现M2型巨噬细胞相关基因IL-10和CD206等分子高表达,而PTPRE-AS1和PTPRE基因的表达水平则显著降低,并且与 CD206等基因呈现负相关。
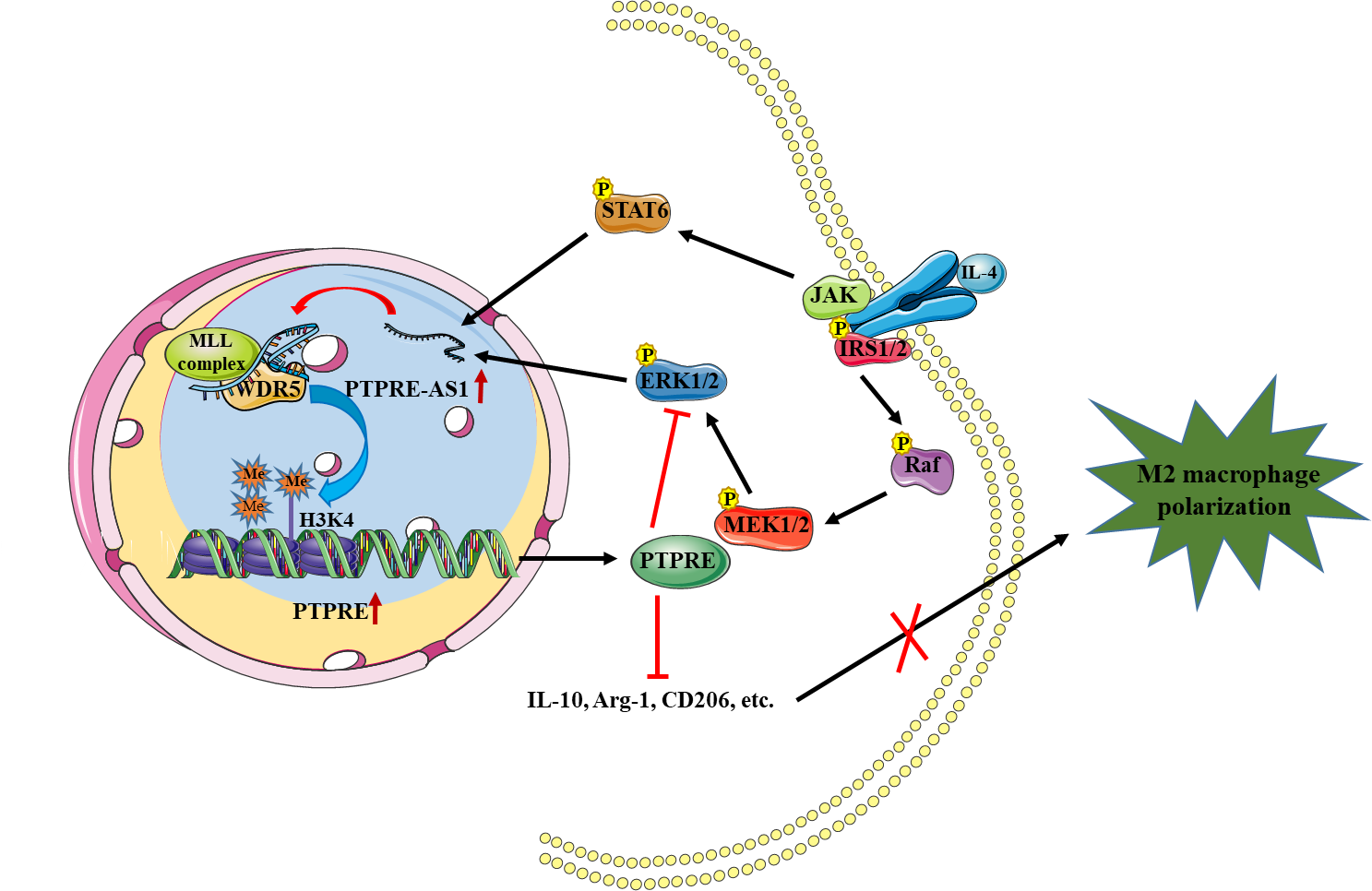
综上,该研究发现长非编码RNA PTPRE-AS1通过与WDR5结合,调控染色质重塑,促进宿主基因PTPRE表达,从而调控M2型巨噬细胞的激活及炎症性肠炎、过敏性哮喘等炎症性疾病的发病过程,进一步地拓展了人们对非编码RNA如何调控巨噬细胞功能及机制的认识,其中的关键分子有望成为治疗炎症性疾病的新靶点。
据悉,复旦大学附属儿科医院助理研究员韩晓、技术员黄赛花、薛萍和付劲蓉医师为文章的共同第一作者,周玉峰研究员为文章的通讯作者。
原文链接:https://advances.sciencemag.org/content/5/12/eaax9230