表观遗传团队报道m6A修饰增强YTHDF蛋白相分离
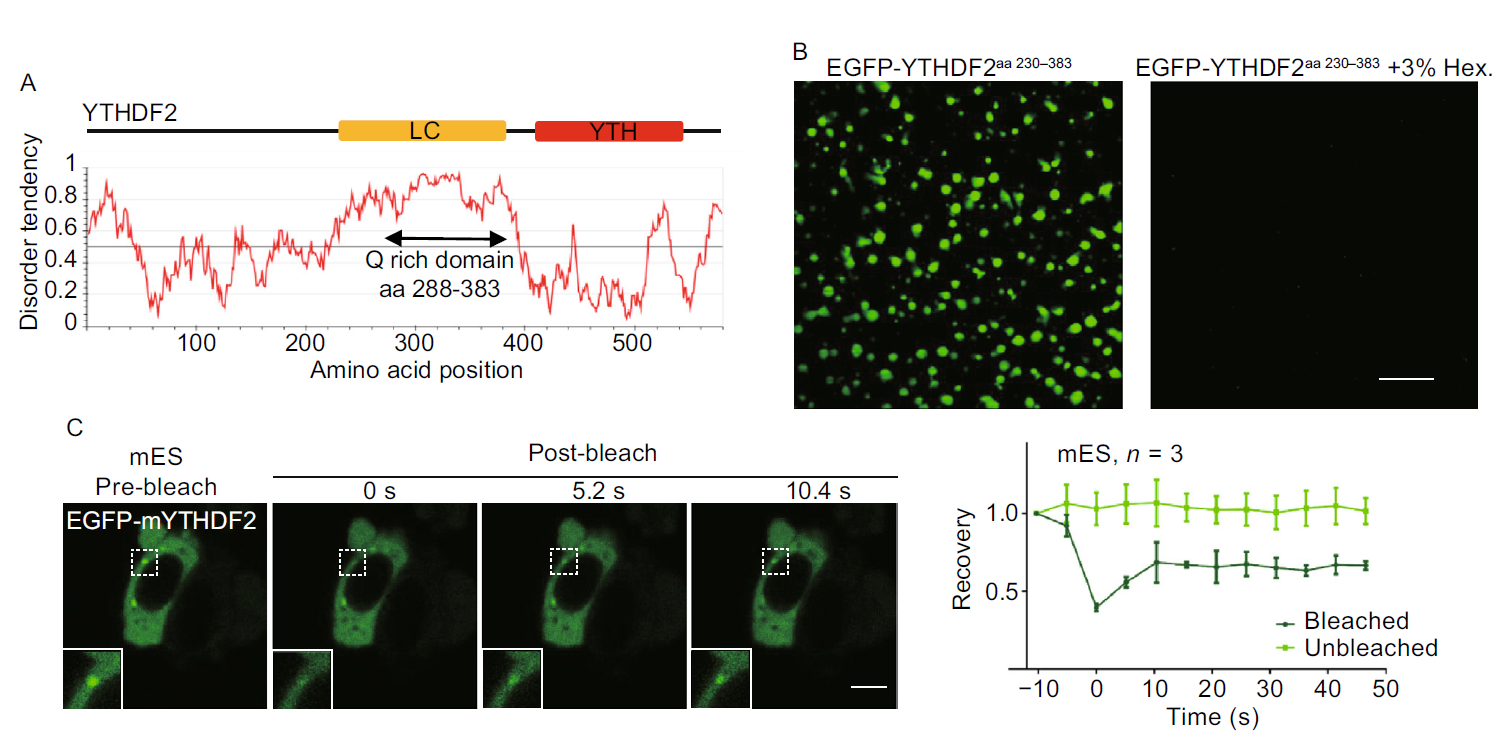
作为哺乳动物中mRNA上含量最多的修饰之一,N6-methyladenosine (m6A)修饰已被研究证明在RNA出核、mRNA剪接、miRNA加工、mRNA的降解和翻译等多种生物学过程中发挥重要作用。不同的m6A阅读蛋白在这些过程中发挥了核心作用,其中,YTHDF2是很特别的m6A阅读器家族(YTHDF1/2/3)中的一员,这个蛋白的C端含有一个m6A识别结构域(YTH domain),N端含有低复杂度结构域(LC),具有发生相分离的潜力,而这个蛋白通过相分离行使功能的调控机制仍有待研究。
近日,我院沈宏杰团队联合哈佛医学院施扬教授、同济大学马红辉研究员等在Protein & Cell上在线发表了题为:“Binding to m6A RNA promotes YTHDF2- mediated phase separation”的letter文章。该文章从“液-液”相分离的角度解释了与m6A修饰的结合对m6A阅读蛋白YTHDF2相分离特性的重要性。

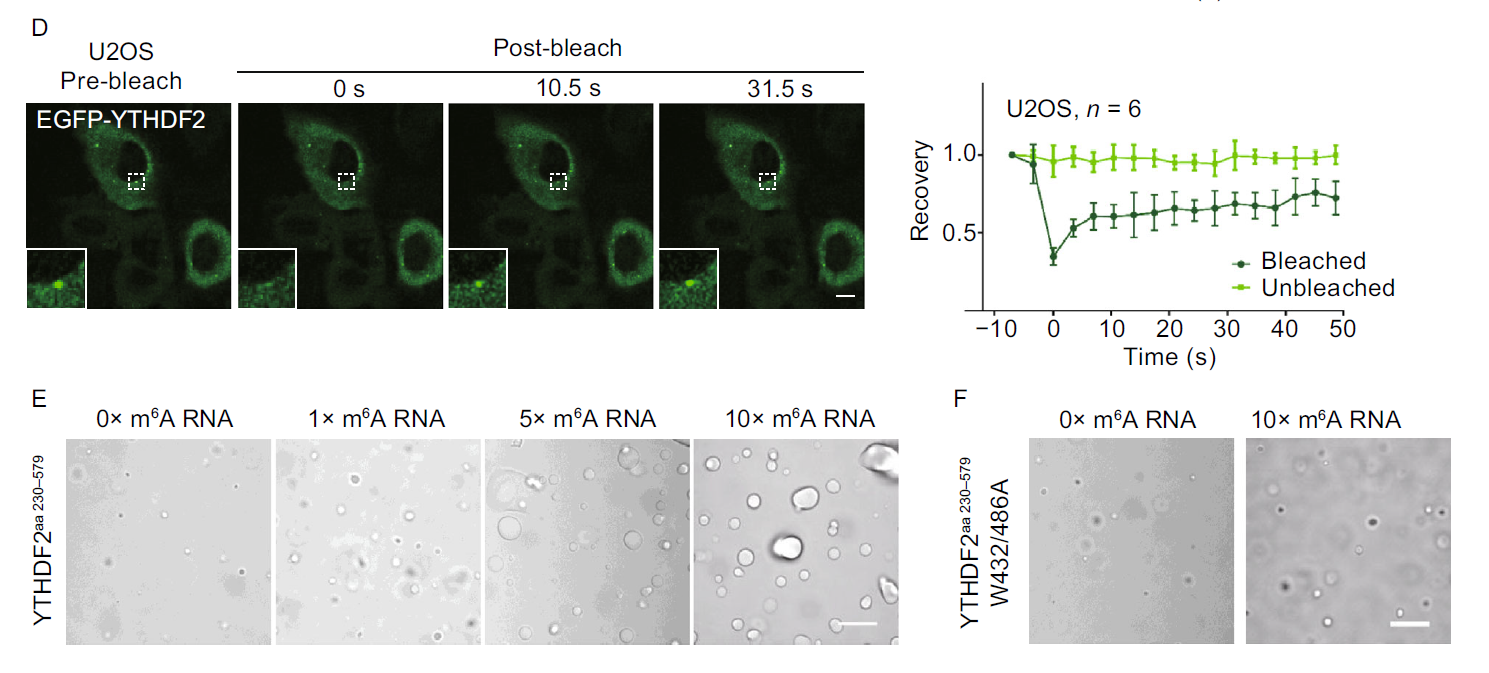
研究人员首先通过预测发现YTHDF2的蛋白序列存在一段LC序列,并通过体外实验证明LC蛋白能够形成相分离。在mES和U2OS细胞中分别过表达鼠源和人源的EGFP-YTHDF2能够看到droplets,FRAP实验表明这些droplets具有流动性,符合相分离特性。研究人员进一步检测RNA上m6A修饰的个数是否会在体外调节YTHDF2蛋白的相分离过程。与LC+YTH蛋白体外孵育的结果表明,带有更多(10个)m6A修饰的50nt长度的RNA能够显著促进蛋白的相分离现象,而只带有1个或5个m6A修饰的RNA则没有类似作用。
除此之外,研究人员推测,识别带有m6A修饰的RNA可能是YTHDF2 蛋白的内在无序区发生相变的必要条件。mES体内过表达实验表明,只有野生型细胞过表达正常YTHDF2蛋白能形成droplets,而过表达YTH识别m6A位点(W432A/W486A)的蛋白无法形成droplets。同时,在Mettl14或Mettl3-knockout的mES细胞中过表达正常YTHDF2蛋白也无法形成droplets。另一方面,体外实验表明W432A/W486A突变的蛋白与带有10个m6A修饰的RNA反应并不会促进蛋白的相分离现象。研究人员发现,YTHDF2的LC蛋白序列含有大量富集的亲水性氨基酸Glutamine,体外实验表明,LC序列内的Glutamine全部突变成疏水性氨基酸Alanine的蛋白几乎不能形成相分离,说明了亲水性氨基酸对LC蛋白的重要性。值得一提的是,YTHDF1和YTHDF3蛋白的LC蛋白在体外也能形成相分离。
基于以上的结果,作者发现了YTHDF2蛋白识别RNA的m6A修饰,对于YTHDF2自身的相分离现象的重要性。这一结果与今年7月份Samie R. Jaffrey课题组在Nature上发表的文章m6A enhances the phase separation potential of mRNA、庄小威实验室在bioRxiv上online的文章m6A-bindingYTHDF proteins promote stress granule formation by modulating phase separationof stress granule proteins和李丕龙课题组8月份在Cell Research发表的letter文章Multivalent m6A motifs promotephase separation of YTHDF proteins都具有一致性,阐述了类似的问题,但更着重于YTHDF2与RNA的binding过程。

据悉,我院沈宏杰青年研究员、哈佛医学院施扬教授和同济大学医学院马红辉研究员为文章并列通讯作者,我院2017级直博生王嘉华为文章的第一作者,2018级直博生王立勇为文章的共同第一作者。
原文链接:https://link.springer.com/article/10.1007%2Fs13238-019-00660-2