复旦大学生物医学研究院徐彦辉课题组报道ATM激酶活性调节的分子机制
DNA损伤(DNA damage)是导致基因组不稳定,细胞癌变或凋亡的重要来源。ATM(ataxia telangiectasia-mutated)是DNA损伤修复过程中的关键的蛋白激酶,可以参与激活细胞周期、DNA损伤修复、转录调节、免疫应答、中枢神经系统发育和代谢的下游通路。人体中 ATM蛋白活性的缺失会导致多效性神经退行性疾病:共济失调毛细血管扩张症(AT),从而引发免疫系统缺陷,癌症易感易发,早衰和胰岛素抵抗型糖尿病。ATM的功能研究已经有20余年,但目前对其激活机制依旧存在很大争议,阻碍了对DNA损伤修复机制的充分理解。
徐彦辉课题组利用冷冻电镜单颗粒重构方法,分别解析了4.3埃分辨率的二聚体非激活状态和7.8埃分辨率的单体激活状态的ATM蛋白结构(下图),并通过生化分析阐明了在DNA双链断裂发生后ATM被激活的分子机制。该项工作于7月18日以Structural Insights into the Activation of ATM Kinase为题在线发表于《Cell Research》(细胞研究)杂志上。
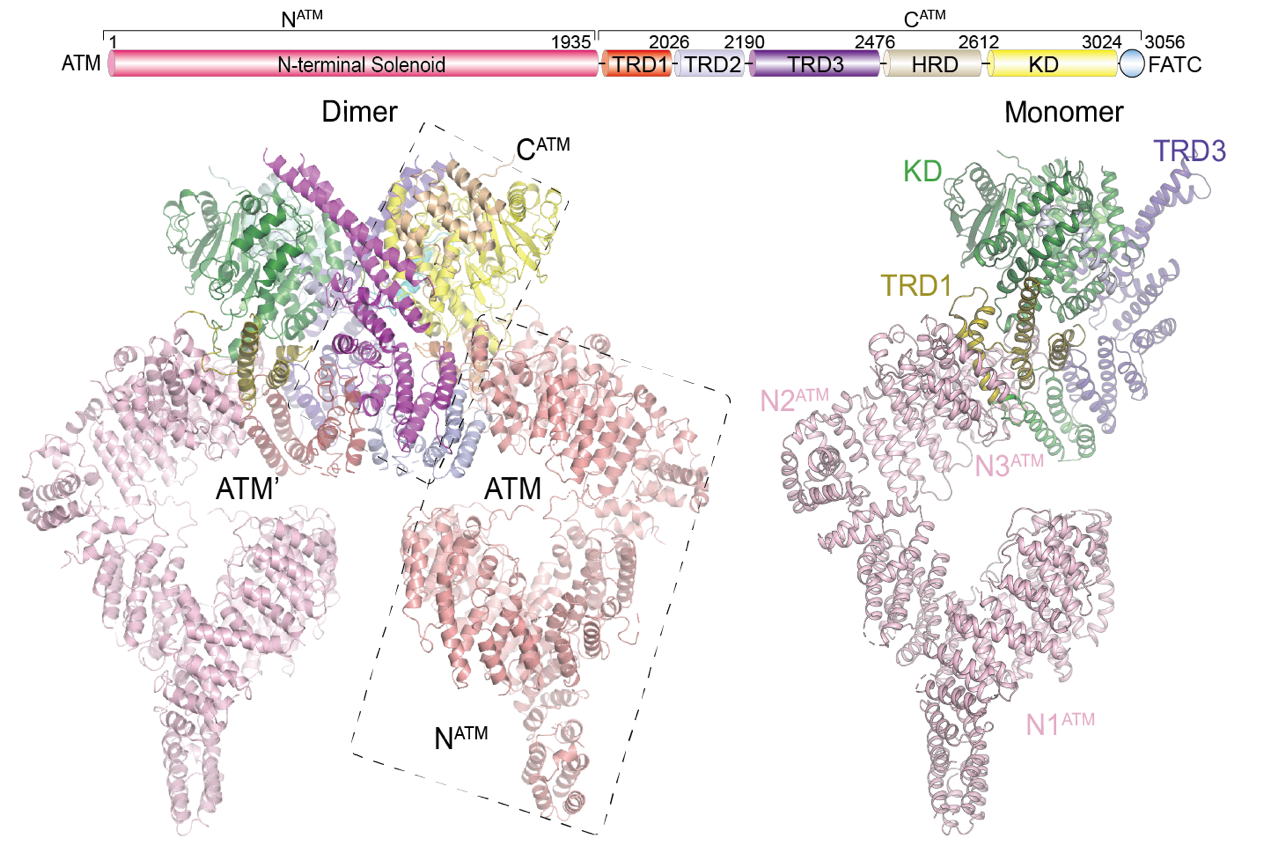
来自徐彦辉课题组的研究人员使用蛋白纯化技术成功分离出单体和二聚状态的ATM蛋白,通过结构和生化水平的分析,发现ATM二聚体在DNA双链断裂损伤后转化为单体状态,使催化位点的自抑制被解除,活性区域的“口袋”张开,从而转化为具有高激酶活性的激活状态。此外,该项研究还发现DNA末端可以强烈地激活ATM的活性,表明ATM的激活是由蛋白构象变化和DNA损伤末端共同调节的。上述研究为更好地理解DNA损伤修复机制提供了一定的基础。
该项工作由复旦大学徐彦辉课题组与英国Electron Bio-Imaging Centre合作完成,肖健雄,刘梦杰,戚轶伦, Yuriy Chaban和高超为本文共同第一作者,徐彦辉研究员为本文通讯作者。
论文原文链接:https://www.nature.com/articles/s41422-019-0205-0