钦伦秀团队合作研究揭秘肝癌免疫逃逸新机制
肿瘤免疫治疗是近年来癌症治疗领域的重大进展,靶向阻断 PD-1/PD-L1免疫检查点抗体疗法在癌症免疫治疗中更是具有里程碑的意义。但存在治疗反应率较低、原发性/继发性耐药等问题,如何提高有效率、克服耐药是研究的热点与难点。癌细胞与微环境相关对话,通过“免疫编辑”等途径,营造抑制性免疫微环境,从而发生免疫逃逸,是影响免疫治疗疗效的重要方面。
近日,Gut杂志上发表了来自我院钦伦秀、董琼珠团队,联合美国MD安德森癌症中心洪明奇团队最新研究成果“Disruption of tumour-associated macrophage trafficking by the osteopontin-induced colony-stimulating factor-1 signalling sensitises hepatocellular carcinoma to anti-PD-L1 blockade”,研究揭秘了肝癌免疫逃逸的新机制,发现了提高肝癌免疫治疗疗效的新途径。

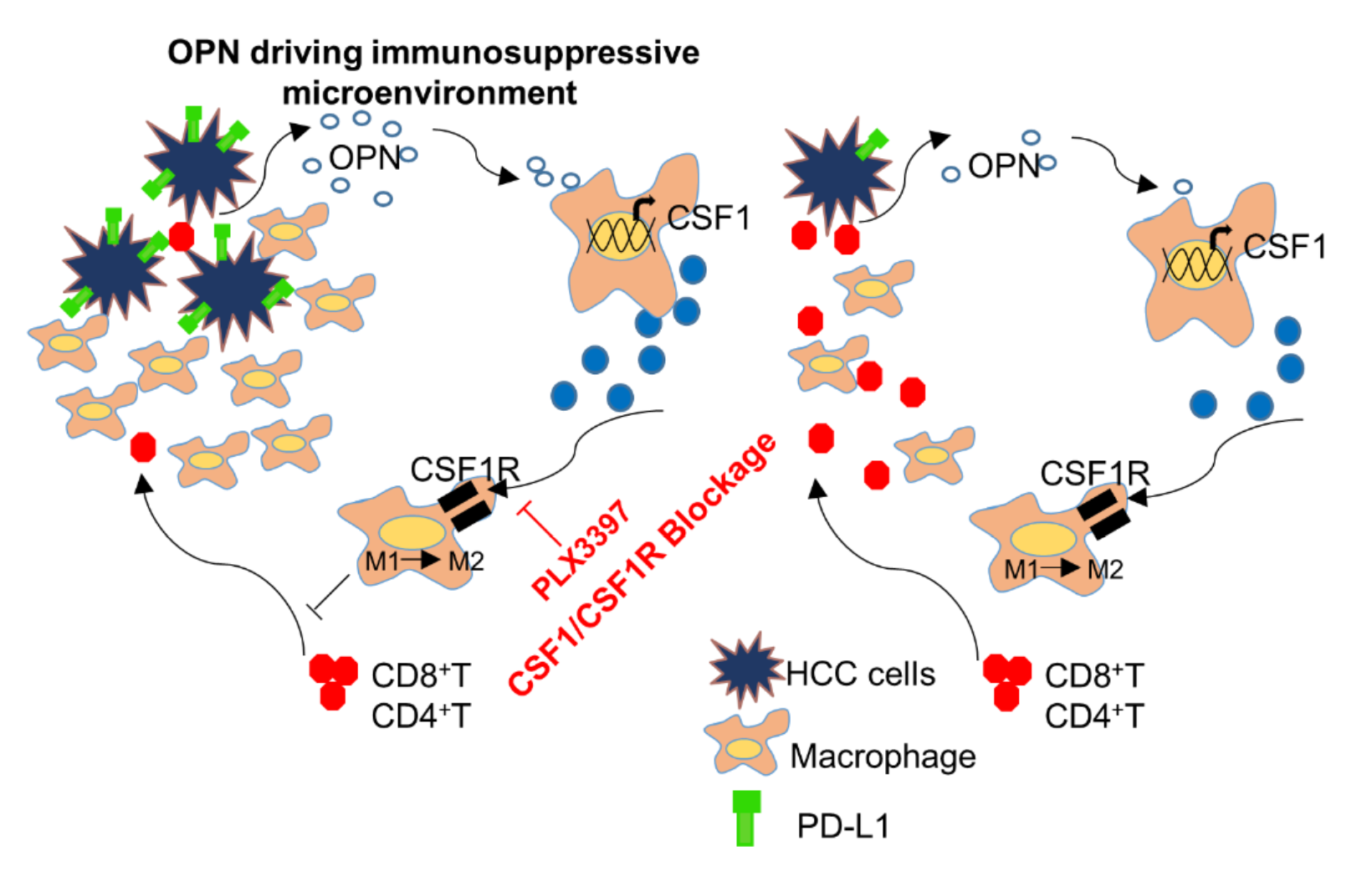
近年来,钦伦秀团队相继在Cancer Cell、Cell Metabolism和Hepatology等期刊发表癌转移研究成果发现,骨桥蛋白(Osteopontin, OPN)是促进肝癌转移的重要基因,可用于肝癌转移复发的预测与监测,并发现微环境炎症免疫反应失衡(Th1/Th2偏移)促进肝癌转移,其中集落刺激因子1(colony-stimulating factor-1, CSF1)是“元凶”。
在上述研究成果基础上,钦伦秀、董琼珠团队联合洪明奇团队应用OPN敲除小鼠、不同转移细胞系、动物模型和临床样本等,进一步研究发现肝癌细胞来源的过量OPN通过PI3K-AKT-p65通路诱导巨噬细胞分泌CSF1,激活巨噬细胞CSF1/CSF1R通路,促进巨噬细胞趋化及M2型极化和Th1/Th2偏移,并上调肝癌细胞PD-L1的表达,营造抑制性免疫微环境,最终导致肝癌免疫逃逸。从“种子”(癌细胞)与“土壤”(肿瘤微环境)对话的全新角度解析了OPN促进肝癌转移的机制。更为重要的是,发现阻断巨噬细胞CSF1/CSF1R通路,可逆转抑制性免疫微环境,增加肿瘤内CD8+T淋巴细胞浸润和杀伤活性,协同增强免疫检查点PD-L1抗体的抗OPN高表达肝癌的疗效。为肝癌患者的个体化免疫治疗提供了新思路。
我院钦伦秀、董琼珠和MD安德森癌症中心洪明奇为本文的通讯作者,附属华山医院普外科朱迎等为本文的第一作者。
原文链接:https://gut.bmj.com/content/early/2019/03/22/gutjnl-2019-318419.long