于文强团队开发了全基因组DNA甲基化导航定位测序,揭示DNA甲基化调控新模式,提出肿瘤转移新机制
如果您专注于以下科学问题,那您一定会对我们所做的研究和发表的文章感兴趣:
1.DNA甲基化检测如何精准检测,同时花费最少?2. 启动子DNA甲基化和基因体甲基化如何协同调节基因的表达?3. DNA甲基化还有没有其他的调控模式?肿瘤基因如C-myc 为何会在肿瘤中高表达,其机制是什么?4.肿瘤免疫耐受与肿瘤细胞自身的表观遗传学调控有什么关系?5.肿瘤细胞为什么会有特异性的器官转移? 我们的研究也许会帮助您打开解决这些问题的另一扇门,获得与众不同的灵感!
随着人类基因组计划的完成,生命科学研究进入了“后基因组时代”,而表观遗传学是“后基因组时代”的前沿方向。DNA甲基化是表观遗传学的核心组成部分,对于正常细胞功能维持、胚胎发育等生命过程至关重要,DNA甲基化紊乱与肿瘤的发生和转移具有密切关系。因此,进行全基因组DNA甲基化的检测和分析对于探索肿瘤的发生发展、转移和复发机制以及开发新的抗肿瘤策略具有重要意义。

近日,复旦大学生物医学研究院教授于文强团队开发了具有自主知识产权的全基因组 DNA 甲基化检测技术——导航定位测序(Guide Positioning Sequencing,GPS)。相比于 WGBS,GPS 具有覆盖率高(高达96%)、可覆盖GC-rich区域和重复序列区域。利用 GPS对正常肝细胞和肝癌细胞进行全基因甲基化测序,分析发现基因体(gene body)和启动子之间的甲基化差异(methylation of gene body difference to promoter,MeGDP)可有效地预测基因表达,启动子和增强子中的“甲基化边界移动(Methylation Boundary Shift,MBS)”能够调控与免疫和肿瘤代谢相关的基因的表达,异常的 DNA 甲基化参与了组织特异性的增强子转换,进而导致细胞身份的转变和肝癌发生发展以及肝癌的特异性肺转移,相关研究于2019年1月22日发表在线发表于Genome Research上。
GPS检测DNA甲基化,优势看得见。目前全基因组 DNA 甲基化检测的“金标准”为重亚硫酸盐测序(Bisulfite-sequencing),结合二代测序,能够以单碱基分辨率检测全基因组范围的 DNA 甲基化。然而,重亚硫酸盐测序的生物信息学分析固有的缺陷造成测序的不准确性和高昂的测序成本。于文强教授团队历时八年,开发了一套新的全基因组 DNA 甲基化检测技术——导向定位测序(Guide Positioning Sequencing,GPS),相比于目前最广泛使用的 WGBS,GPS 具有以下优点: 1. 单碱基分辨率的全基因组DNA甲基化位点检测;2.能够区分DNA模板正负链甲基化; 3. 能够覆盖基因组几乎所有重复片段;4. 检测费用大幅下降; 5.GPS可以同时检测基因组和表观基因组信息。应用 GPS 检测正常肝细胞以及两个肝癌细胞系 97L 和 LM3 中全基因组 DNA 甲基化发现,在人类正常肝细胞中,GPS 对 CpG 位点覆盖率达 97%,胞嘧啶的覆盖率达 96%;在肝癌细胞系 97L 细胞中,GPS 的比对率为 80.9%,比 WGBS 的覆盖率高 15~20%。
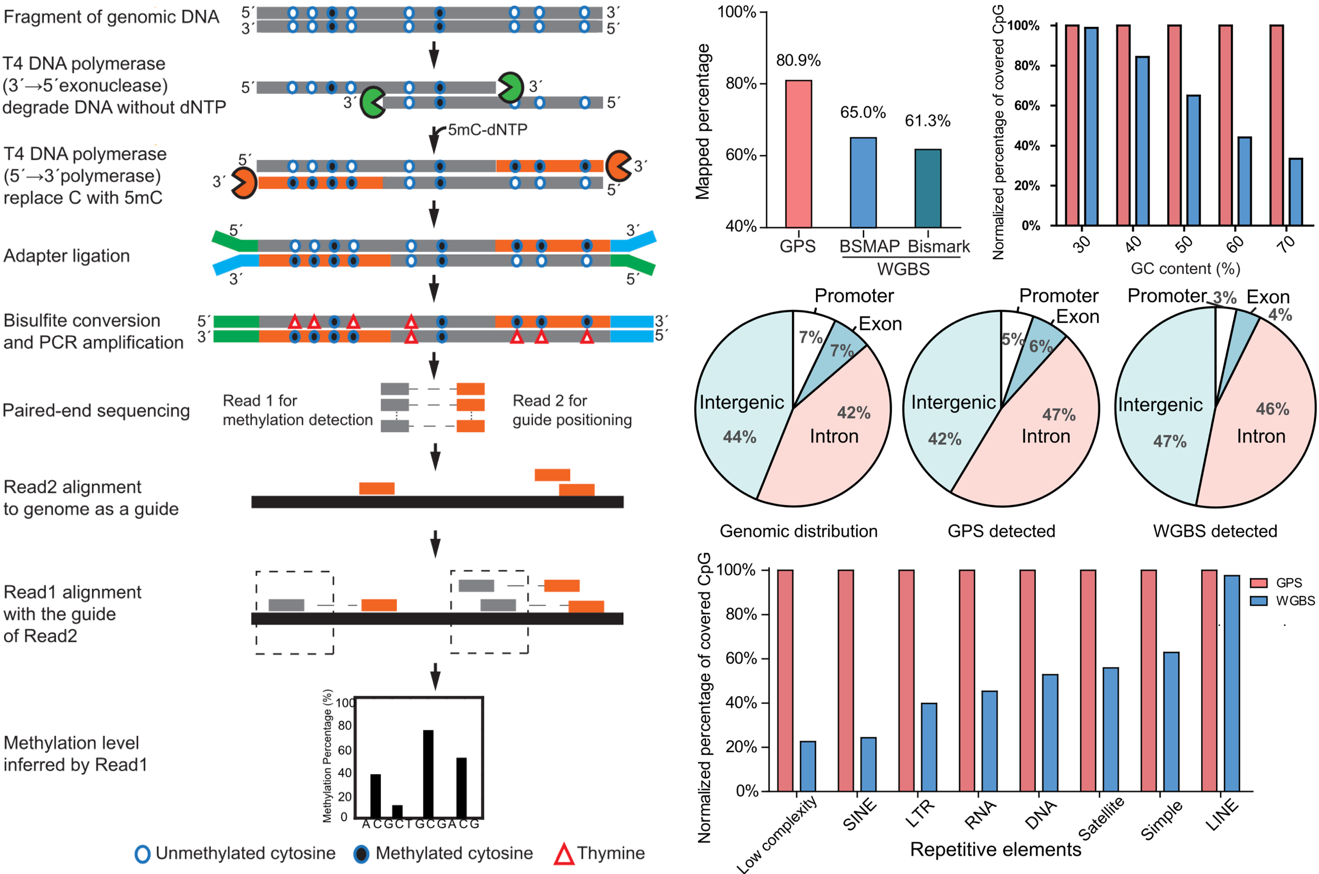
GPS 工作原理以及与 WGBS 的比较
MeGDP开启肿瘤内源性甲基化与肿瘤免疫耐受研究的新篇章。启动子区域的DNA甲基化与基因的表达沉默有关,但从全基因组水平来看,启动子区域的DNA甲基化与基因表达没有关系。通过对GPS检测数据的分析,我们发现基因体和启动子区域的 DNA 甲基化差异与基因表达之间存在很强的相关性,并将基因体和启动子区域的 DNA 甲基化差异定义为 MeGDP(methylation of gene body difference to promoter)。MeGDP 与基因表达之间的相关系数 Rho 高达 0.67,提示 MeGDP 可以做为基因表达的预测因子。在肝癌细胞中,MeGDP 降低与免疫系统以及代谢紊乱相关。这些结果提示,在肿瘤发展过程中,肿瘤细胞自身内源性的免疫相关的分子通过 DNA 甲基化沉默可能是肿瘤细胞免疫逃逸的重要原因。

MBS,DNA甲基化调控基因表达的新模式。我们经常会遇到即使启动子的区域DNA低甲基化,但基因表达水平还是不同。我们通过分析启动子区域的DNA低甲基化区域的宽度,发现相比于正常肝细胞而言,肿瘤细胞可能在启动子区域有更宽的低甲基化。我们将转录起始位点附近的 DNA 甲基化边界变化命名为“甲基化边界漂移“,即MBS(Methylation Boundary Shift,MBS)”。进一步研究发现,MBS向TSS下游的延伸与基因的高表达有关,而这些高表达的基因与核糖体基因的合成和细胞周期相关,而这些基因无疑与肿瘤密切相关。
增强子做为重要的顺式调控原件,同样受到MBS的调控。与正常肝细胞相比,研究发现 97L 细胞通过MBS改变了增强子的状态,导致肿瘤细胞中增强子的获得或丢失,而增强子区域的异常 DNA 甲基化模式可能调改变强子特性以及所调控的基因表达,赋予肿瘤细胞新的特性,继而与肿瘤的发生发展和转移有关。
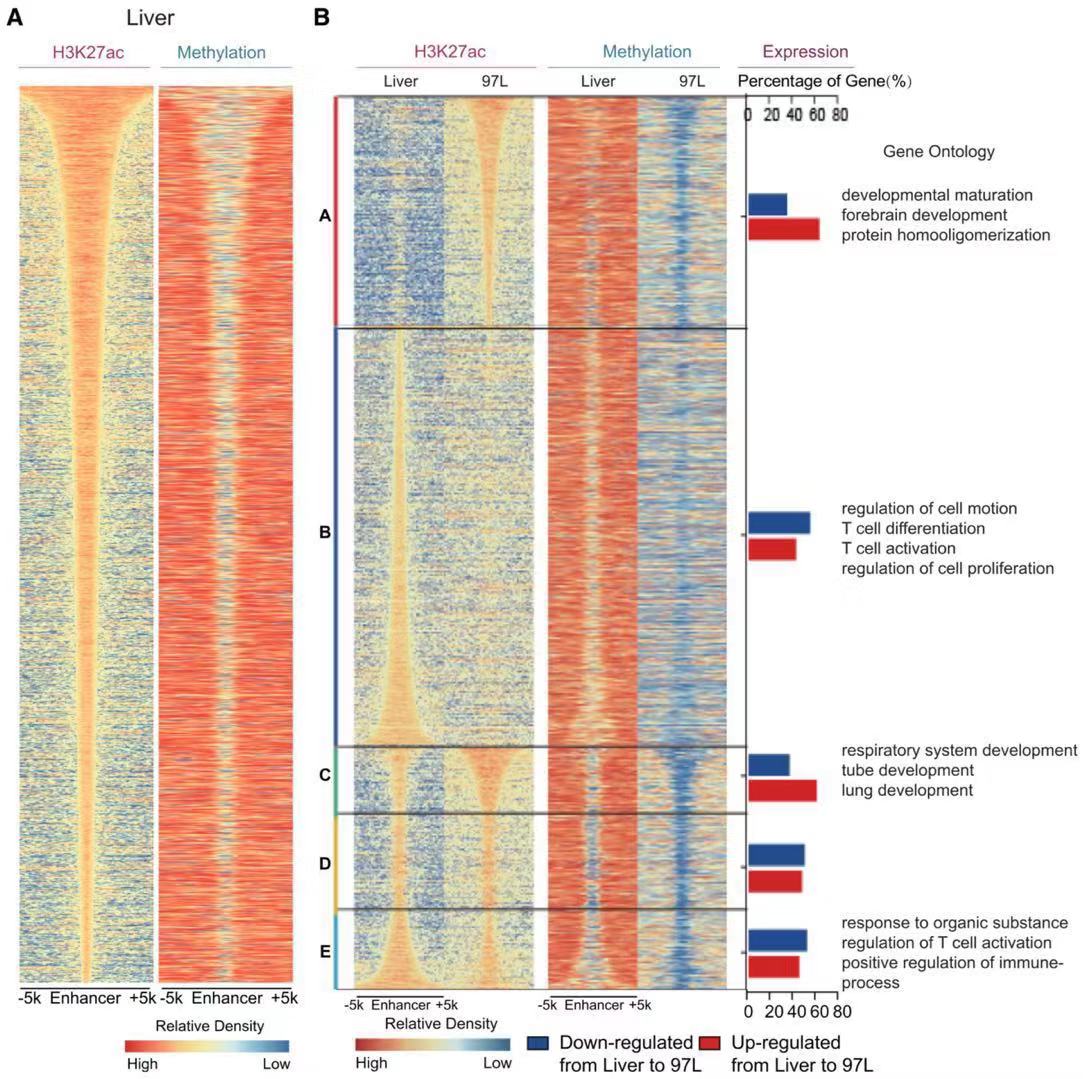
MBS 与增强子的改变相一致
“同化共生”,肿瘤转移的新机制。物以类聚,人以群分,肿瘤的发生和转移也一样。肿瘤转移是肿瘤治疗失败的重要原因之一,而肿瘤特异性的器官转移机制并不清楚。例如肝癌容易发生肺转移,我们通过分析肝癌细胞97L和肝癌特异性转移到肺的LM3细胞的DNA甲基化模式和基因表达情况,发现肝细胞特异性的基因表达降低,而肺细胞特异性的基因表达上调提示肝细胞身份丢失和肺细胞身份的获得是肝癌发生肺转移的重要原因。 我们的结果表明,在97L 和 LM3 肝癌细胞系中,肝特异性高表达的基因的数目分别降低了 74% 和 80%;而肺特异性 CKS2 在 97L 和 LM3 中的表达升高,与此同时,在肝癌细胞中的肝特异性增强子减少和肺特异性的增强子增加与 DNA 甲基化异常模式相关。我们认为增强子区域异常的 DNA 甲基化异常模式可以调控增强子的漂移并影响相关靶基因的表达。我们认为肿瘤细胞通过改变身份,与特异性转移的器官组织细胞通过表观遗传学的机制,进而“同化共生“,肝癌细胞中表达的肺特异性的基因可以帮助肝癌细胞更好地适应肺环境,提示肿瘤细胞身份的丢失以及其他细胞身份的获得是肿瘤发生和转移的重要原因,而同化共生可能是肿瘤发生特异性器官转移的重要分子机制。
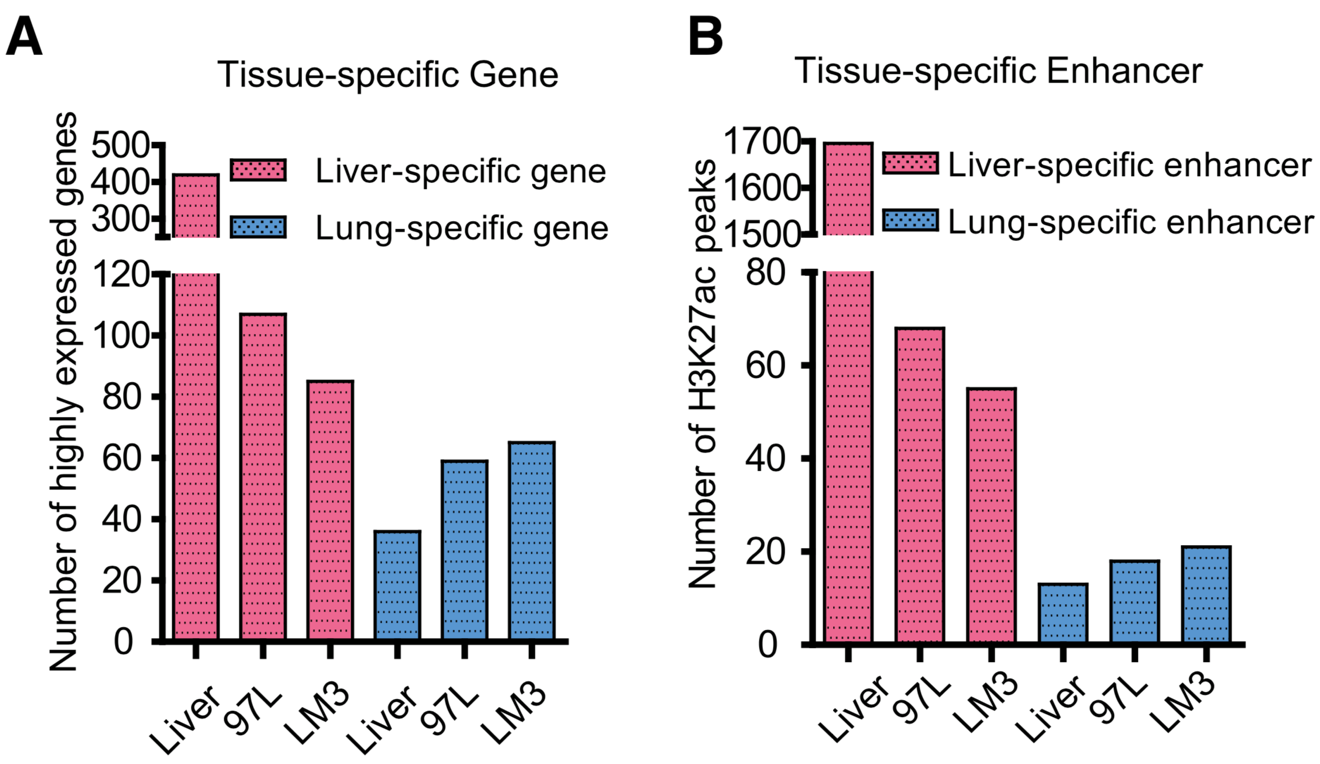
具有肺转移潜能的肝癌细胞中肝特异性基因表达降低,而肺特异性基因表达升高
复旦大学生物医学研究院博士李晋、李岩,助理研究员李伟,博士罗怀兵,博士后奚艳萍,博士生董世华,国防科技大学博士高明为本文共同第一作者,复旦大学生物医学研究院于文强研究员,吴飞珍助理研究员以及国防科技大学彭邵亮教授为本文共同通讯作者。本研究得到了科技部、上海市科委基础研究重大专项、上海市“科技创新行动计划”、国家自然科学基金、国家“863”计划等经费的支持。
原文链接:https://genome.cshlp.org/content/early/2019/01/21/gr.240606.118.abstract