黄鑫欣团队发现激活一氧化氮通路可以促进造血干细胞的归巢和植入
造血干细胞(Hematopoietic Stem Cell, HSC)是一类具有多能性并能够自我更新的成体干细胞,一直以来都是细胞治疗和基因治疗的前沿和研究热点【1】。造血干细胞移植之后可以重建机体的血液和免疫系统,因此在临床上广为应用,是治疗各种遗传性和恶性血液疾病的最有效方法【2】。当前我国等待造血干细胞移植的患者有100 多万,并且每年都有大量新增患者,如果能够进一步增加造血干细胞移植效率,将有助于提高移植成功率和患者的存活率,具有很高的临床应用价值。
脐带血是临床移植所用的造血干细胞的重要来源之一,脐带血移植具有一系列优势,例如资源丰富,配型相对容易,移植后发生抗宿主反应和病毒感染的风险较低等,在临床上应用于治疗80 多种血液疾病和遗传性疾病【3】。迄今脐带血移植已有45000 多例,世界各国陆续建立了450 多个脐带血库。限制脐带血更广泛应用的一个关键瓶颈是接受脐带血移植的患者,尤其是成人患者移植后的造血功能恢复和免疫系统重建迟缓。为了解决这个瓶颈问题,最近的研究聚焦在通过新的方法增加干细胞迁移到骨髓中——归巢(Homing)来促进移植效率【4-6】。
2020年3月3日,我院黄鑫欣课题组和美国印第安纳大学Hal Broxmeyer课题组合作在Leukemia杂志上发表了文章“Pharmacological activation of nitric oxide signaling promotes human hematopoietic stem cell homing and engraftment”,首次报道了一氧化氮通路在促进人源脐带血造血干细胞归巢和移植方面的作用,以及进一步运用靶向该信号通路的小分子增进临床造血干细胞移植的潜在策略。

一氧化氮是一类气体小分子,也是哺乳动物细胞中一种重要的信号分子,参与调控各种生理过程,例如突触可塑性、内皮细胞松弛和免疫反应。一氧化氮可以自由穿过细胞膜,并激活细胞质中的鸟苷基环化酶(soluble guanylate cyclase, sGC)。sGC进一步把三磷酸鸟苷(GTP)转变成环磷酸鸟苷(cGMP),cGMP充当重要的第二信使,再激活cGMP依赖性蛋白激酶(PKG),从而广泛的调节下游过程。cGMP特异性的磷酸二酯酶5(PDE5)参与降解细胞内的cGMP,使信号减弱,是一氧化氮通路的负调控因子。
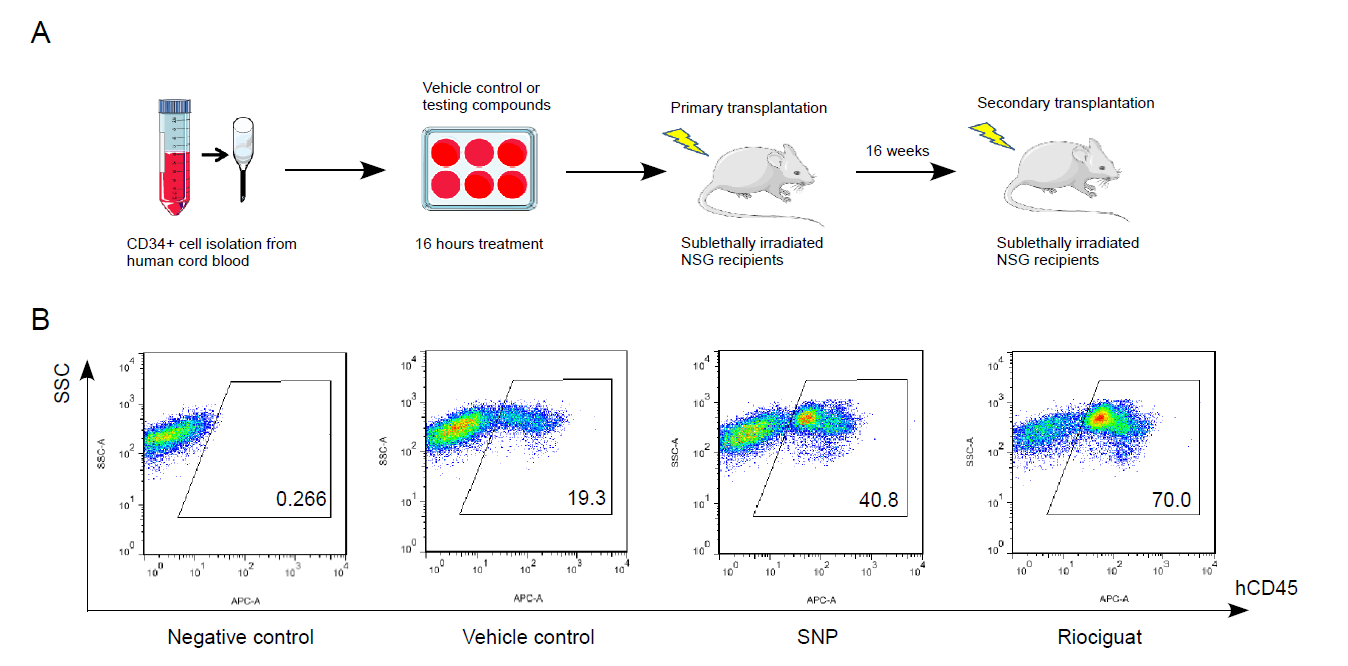
研究者先从脐带血中分离得到富含造血干细胞和前体细胞的CD34阳性细胞,预处理SNP(一氧化氮供体)和Riociguat(sGC激动剂),再通过免疫缺陷小鼠的移植模型分析不同处理组之间在体移植的效果差异。研究发现预处理SNP和Riociguat相比对照组能够增加造血干细胞的在体移植效率,促进干细胞的长期植入。同时,运用PDE5的抑制剂Sildenafil也具有相同的效果,验证了一氧化氮通路的激活能够促进CD34阳性细胞在小鼠的骨髓中的植入效果。
研究者通过转录组分析发现一氧化氮信号的激活能够促进细胞迁移相关基因的表达,其中CXCR4的转录水平有显著增加。研究者进一步验证了造血干细胞表面CXCR4蛋白水平也同样显著增加,并运用体外的细胞迁移实验发现激活一氧化氮信号通路可以促进CD34阳性细胞向SDF1的趋化迁移(chemotaxis)。最后,研究者用在体实验证明了一氧化氮的激活能够促进造血干细胞的归巢。
总的来说,该研究的一大亮点是丰富了促进造血干细胞归巢和移植的机制,并充分阐明了一氧化氮信号通路在造血干细胞归巢过程中的重要作用,为进一步的临床应用提供理论依据。下一步的研究目标将是临床验证这一方法的可行性。
据悉,黄鑫欣课题组的研究助理徐丹华和复旦大学附属妇产科医院的主治医师杨旻为论文的共同第一作者,黄鑫欣博士和美国印第安纳大学医学院的Hal Broxmeyer教授为本文的共同通讯作者,该工作还得到了上海交大医学院郭滨研究员和印第安纳大学的Maegan Capitano和万钧教授的大力支持和帮助。
原文链接:
https://www.nature.com/articles/s41375-020-0787-z
参考文献
1. Doulatov S, Notta F, Laurenti E, Dick JE. Hematopoiesis: a human perspective. Cell Stem Cell 2012 Feb 3; 10(2): 120-136.
2. Copelan, E. A. Hematopoietic stem-cell transplantation. The New England Journal of Medicine 2006 Apr; 354:1813-1826
3. Ballen KK, Gluckman E, Broxmeyer HE. Umbilical cord blood transplantation: the first 25 years and beyond. Blood 2013 Jul 25; 122(4): 491-498.
4. Huang X, Broxmeyer HE. Progress towards improving homing and engraftment of hematopoietic stem cells for clinical transplantation. Curr Opin Hematol. 2019 Jul 26(4):266-272.
5. Huang X, Guo B, Liu S, Wan J, Broxmeyer HE. Neutralizing negative epigenetic regulation by HDAC5 enhances human haematopoietic stem cell homing and engraftment. Nat Commun 2018 Jul 16; 9(1): 2741.
6. Guo B, Huang X, Cooper S, Broxmeyer HE. Glucocorticoid hormone-induced chromatin remodeling enhances human hematopoietic stem cell homing and engraftment. Nat Med 2017 Apr; 23(4): 424-428.