胡晋川/钱茂祥课题组《Nucleic Acids Research 》合作开发单碱基分辨率DNA氧化损伤测序方法
生命活动需要氧化反应提供能量,这一过程同时会产生活性氧物质(ROS)。ROS能诱导多种DNA氧化损伤,其中最常见的是8-oxo-7,8-dihydro-2'-deoxyguanosine (OG),被视为氧化压力的标志物。如果没有被及时修复,OG可能引起G→T突变,与多种癌症、神经退行性疾病和衰老相关。除此之外,OG也有类似于表观遗传修饰的作用,可以通过几种不同的方式调控基因表达,例如OG的修复中间体apurinic (AP) site可以通过促进和稳定富含G碱基的DNA二级结构G四链体(G-quadruplexes, G4)来影响转录。
OG的上述生物学功能与其在基因组上的分布密切相关,因此检测OG在基因组上准确位置对研究相关科学问题有重要意义。2021年11月12日,复旦大学生物医学研究院的胡晋川课题组和钱茂祥课题组合作在Nucleic Acids Research 杂志在线发表了题为Genome-wide analysis of 8-oxo-7,8-dihydro-2'-deoxyguanosine at single-nucleotide resolution unveils reduced occurrence of oxidative damage at G-quadruplex sites 的研究论文,开发了一种能以单碱基分辨率特异性检测OG损伤的测序方法CLAPS-seq (Chemical Labeling And Polymerase Stalling Sequencing),检测了HeLa细胞中内源和外源OG损伤的分布,发现了G4结构会阻碍OG损伤的形成。

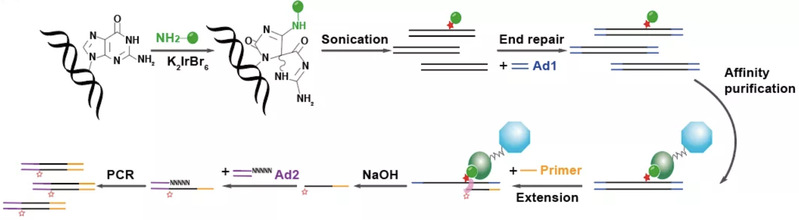
OG损伤的测序有几个技术难题,首先内源OG损伤的频率小于每百万碱基一个,实现特异性和单碱基分辨率具有很高的挑战性;其次G碱基很容易被氧化,如何避免样品处理过程中次生氧化的干扰是所有OG检测方法的共同困难。CLAPS-seq在提取DNA之后,立即通过一个高选择性的化学反应给OG标记上生物素,从而避免了后续处理过程中次生氧化的干扰。生物素标记的DNA片段被链霉亲和素磁珠捕捉,随后用高保真DNA聚合酶进行引物延伸。因为聚合酶会被准确阻挡在损伤前一位碱基,对延伸产物测序可以确定损伤的准确位置(图2)。从测序结果看,无论是内源损伤还是外源损伤,检测到的损伤位点上大部分碱基都是G,表明CLAPS-seq首次实现了以单碱基分辨率检测人类细胞中内源OG损伤的准确分布。
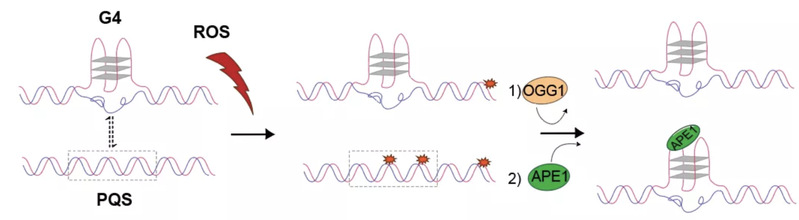
作者分析了OG损伤与局部GC含量、染色质状态以及基因分布的关系,发现在GC富集的转录起始位点附近OG反而比较少,且OG与G4结构的分布具有负相关性;另一方面,没有形成G4结构的“潜在四链体序列”(Potential Quadruplex Sequence, PQS)却成为OG的热点。这些结果为OG和G4的关系提示了一种可能的机制:由于G4结构上的OG难以被修复,G4结构抑制OG形成可以降低突变的风险,保护基因组的完整性;与之相反,未形成G4的PQS上的OG可以被正常识别,其修复中间体AP位点可以促进G4结构的形成,从而起到氧化压力感受器的作用,调控下游基因表达(图3)。
复旦大学生物医学研究院青年研究员胡晋川和钱茂祥是论文的共同通讯作者,复旦大学生物医学研究院19级博士研究生安娇、研究助理殷梦蝶和19级硕士研究生尹家勇为论文的共同第一作者,复旦大学生物医学研究院徐国良教授和美国北卡大学教堂山分校医学院Aziz Sancar教授为本研究提供了重要帮助。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab1022/6426063