Nat Commun | 徐彦辉团队揭示pre-mRNA加帽修饰偶联Pol II启动子近端暂停的分子机制
转录是生物体内遗传信息破译的关键步骤。RNA聚合酶II(RNA polymerase II, Pol II)转录产物mRNA前体(pre-mRNA)需要经过一系列加工才能形成功能性mRNA,5′端加帽是新生pre-mRNA发生的第一步修饰,帽结构具有维持RNA的稳定性、参与RNA转运和翻译等重要生理功能。
m7GpppN是最保守的帽结构,而高等真核生物中,还可以形成更高级的m7GpppNm帽结构。m7GpppNm的形成过程分别由具有双重酶活性的RNA鸟苷酸转移酶及5′磷酸酶(RNA guanosine transferase and 5′-phosphatase, RNGTT)、RNA甲基转移酶(RNA methyl-transferase, RNMT)和帽甲基转移酶1(cap methyltransferase1, CMTR1)催化完成。
加帽酶的招募和激活由Pol II羧基末端结构域(carboxy-terminal domain, CTD)的Ser5磷酸化和转录因子DRB敏感性诱导因子(DRB sensitivity-inducing factor)DSIF共同调控。多项研究表明,pre-mRNA加帽发生在转录早期阶段,即新生pre-mRNA长度为20-60 nt时。在高等真核生物中,DSIF和负延伸因子(negative elongation factor, NELF)与Pol II结合形成暂停延伸复合物(paused elongation complex, PEC),使得转录基本处于停滞状态,这一暂停过程也多发生在启动子近端,这极有可能为RNA的共转录加工提供了时间窗口。但直至目前,pre-mRNA加帽与启动子近端暂停相互关联的分子机制尚不清楚。
2024年5月30日,复旦大学生物医学研究徐彦辉团队在Nature Communications杂志上在线发表题为Structures of co-transcriptional RNA capping enzymes on paused transcription complex的研究论文。该研究利用单颗粒冷冻电镜技术,解析了两种共转录加帽复合物的冷冻电镜结构,结合体外活性实验,揭示了加帽酶结合转录复合物的结构功能特征。

研究团队分别获得了分辨率为3.53 Å的PEC- RNGTT复合物和分辨率为4.0 Å的PEC- RNGTT-CMTR1复合物的冷冻电镜结构。结构表明,在PEC- RNGTT复合物中,RNGTT结合在Pol II Stalk附近,其OB fold结构域插入到Stalk的底部,将RNGTT的TPase结构域定位在Pol II表面的RNA出口通道(RNA exit tunnel)周围。DSIF的构象与先前报道的PEC中的结构相似,NELF可以与RNGTT在转录机器上共存(图1)。
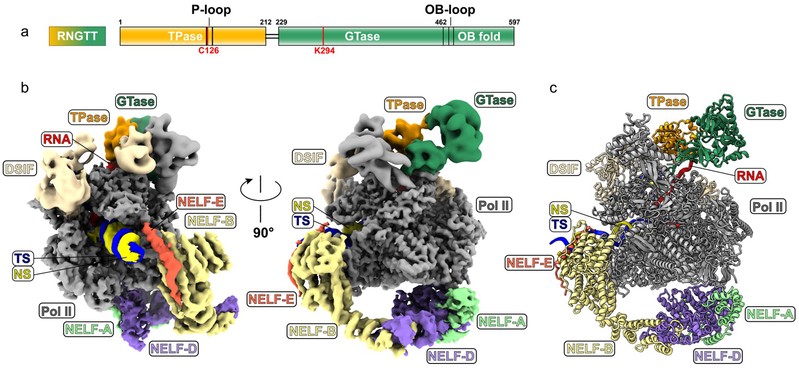
图1 PEC-RNGTT复合物的整体结构。a. RNGTT结构域示意图。中间白色的部分没有进行模型搭建;b. 两个角度的PEC-RNGTT复合物冷冻电镜电子密度图;c. PEC-RNGTT复合物的结构模型图。
此外,研究人员还在此复合物中观察到了NELF结合Pol II的非经典构象“Down”构象。通过结构比较发现,NELF亚基NELF-B和NELF-E与Pol II的结合位置改变,亚基NELF-A和NELF-D组成的模块发生了大规模重排。这些构象变化解除了NELF对于Pol II转录关键元件trigger loop的限制,允许Pol II进行转录延伸(图2)。
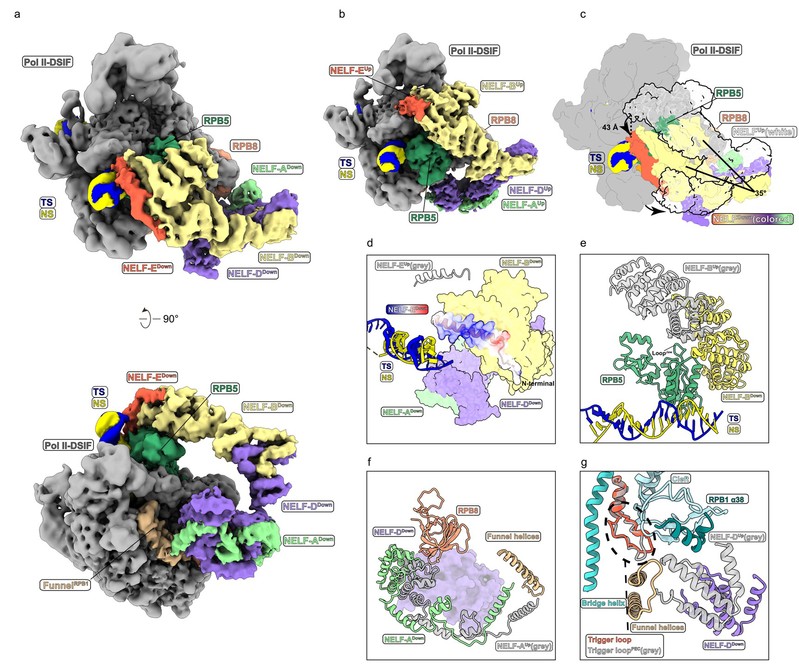
图2 NELF结合Pol II的两种构象。a. 两个不同角度的PEC-RNGTT(NELFDown)的冷冻电镜密度图;b. 两个不同角度的PEC-RNGTT(NELFUp)的冷冻电镜密度图;c. 两种构象的NELF复合物结构比较示意图;d. PEC-RNGTT(NELFDown)构象的NELF-E结构示意图及与up构象NELF-E的比较示意图;e. 两种构象中的NELF-B亚基的结构比较示意图;f. 两种构象中的NELF-A-NELF-D模块的结构比较示意图;g. 两种构象中的NELF-D与trigger loop的相互作用发生改变。
在PEC-RNGTT-CMTR1复合物中,研究人员发现,RNGTT与Pol II的相互作用面不变, CMTR1结合在Stalk的不同位置,二者与RNA exit tunnel相邻,便于抓取新生成的pre-mRNA;DSIF则保持与PEC-RNGTT中相似的构象。CMTR1存在多个分子内相互作用位点,其GTase-like结构域介导了CMTR1与Pol II的结合(图3)。
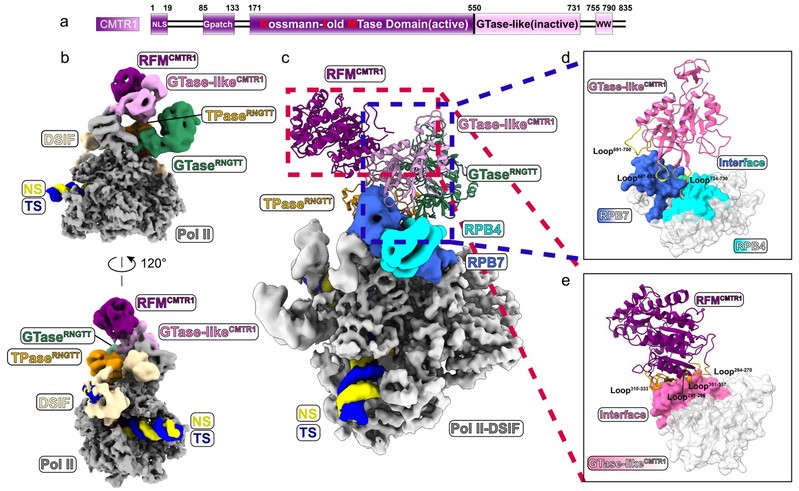
图3 PEC-RNGTT-CMTR1复合物结构。a. CMTR1结构域的示意图;b. 两个角度的PEC-RNGTT-CMTR1复合物冷冻电镜密度图;c. 加帽酶结合在Pol II Stalk上的示意图;d. CMTR1 GTase-like结构域与Stalk结合面的局部放大图;e. CMTR1 GTase-like结构域与RFM结合面的局部放大图。
该项工作为加帽酶与暂停因子在RNA 聚合酶II的共存提供了直接的结构生物学证据,阐明了pre-mRNA的5′端加帽修饰与转录机器在转录暂停阶段偶联的分子机制,并在共转录加帽复合物中捕捉到了NELF复合物与Pol II结合的非经典构象,为深入理解共转录加帽过程及转录暂停调控提供了新的依据。
复旦大学附属肿瘤医院2019级直博生李妍、复旦大学生物医学研究院青年研究员/附属肿瘤医院双聘副研究员王茜敏为本文共同第一作者,复旦大学生物医学研究院副研究员/附属肿瘤医院双聘副研究员李泽为通讯作者。复旦大学附属肿瘤医院研究员/生物医学研究院双聘研究员徐彦辉为本项研究提供了重要的指导与支持。
原文链接:https://www.nature.com/articles/s41467-024-48963-1