Signal Transduction and Targeted Therapy丨柳素玲团队等发现趋化因子CCL20通过重塑肿瘤免疫微环境促进乳腺癌进展的新机制
肿瘤微环境(tumor microenvironment,TME)在肿瘤恶性和治疗抵抗中发挥着重要作用。近年来,根据TME特点挖掘潜在靶点并开发安全有效的免疫疗法逐渐成为乳腺癌治疗的研究热点。2018年7月27日,复旦大学生物医学研究院/附属肿瘤医院柳素玲团队在PLOS Biology杂志在线发表了题为CCL20 triggered by chemotherapy hinders the therapeutic efficacy of breast cancer的研究性论文,揭示了化疗响应细胞因子CCL20通过影响乳腺肿瘤干细胞(Breast cancer stem cells,BCSCs)来促进TNBC的紫杉烷类(紫杉醇和多西他赛)耐药的具体机制。然而,CCL20是如何重塑TME来调控乳腺肿瘤进展的具体机制尚不清楚。
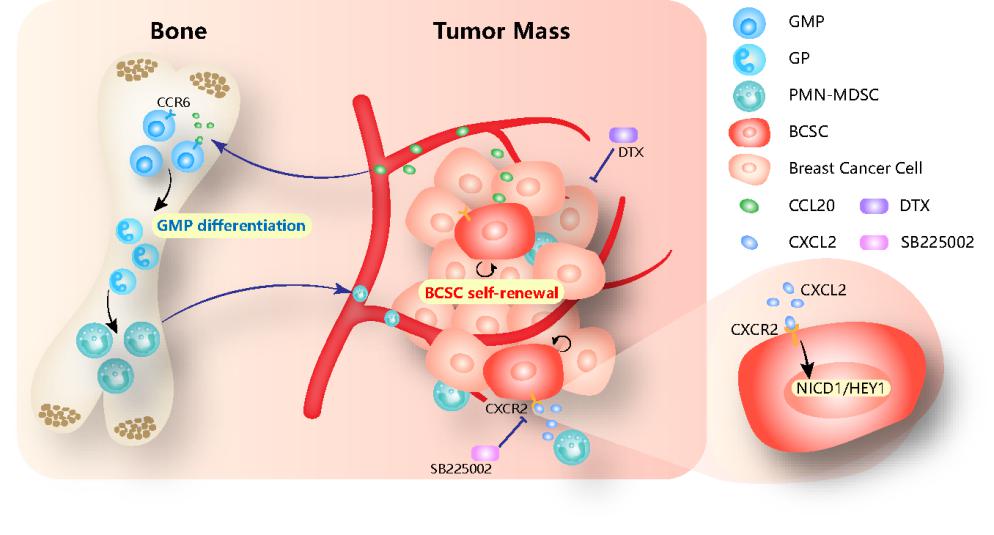
2023年3月1日,柳素玲团队在Signal Transduction and Targeted Therapy杂志在线发表了题为PMN-MDSCs modulated by CCL20 from cancer cells promoted breast cancer cell stemness through CXCL2-CXCR2 pathway的研究性论文,揭示了趋化因子CCL20通过诱导髓系祖细胞GMPs的分化,促进TME中具免疫抑制功能的粒细胞系MDSCs(PMN-MDSCs)扩增,PMN-MDSCs再通过分泌CXCL2,激活肿瘤细胞CXCR2/NOTCH1/HEY1信号通路,导致乳腺肿瘤干细胞富集的新机制,为同时靶向乳腺肿瘤干细胞和干预肿瘤干细胞与免疫抑制微环境的互作进而改善乳腺癌的临床治疗提供了新的方向。

为了探究CCL20对乳腺癌TME的重塑作用,作者构建了CCL20过表达的乳腺癌稳定细胞株及相应的乳腺癌原位移植瘤小鼠模型。体内成瘤实验结果显示,CCL20不仅能够促进乳腺肿瘤生长,还能诱导TME中PMN-MDSCs的富集。利用流式细胞术和体外克隆形成等实验,作者发现CCL20通过其受体CCR6诱导GMPs的粒系分化,促进PMN-MDSCs的扩增。机制上,他们证实了CCL20过表达乳腺癌原位移植瘤来源的PMN-MDSCs(即CCL20驯化的PMN-MDSCs)能够分泌大量的CXCL2,通过与肿瘤干细胞表面受体CXCR2互作,进一步激活NOTCH1/HEY1信号通路来增加BCSCs富集,从而促进乳腺癌进展。
基于CCL20促进乳腺癌进展的具体机制,作者设计了强效选择性CXCR2拮抗剂SB225002和多烯紫杉醇联合治疗的新策略,以克服乳腺癌的化疗耐药。免疫健全小鼠及免疫系统人源化小鼠乳腺癌原位移植瘤模型的联合治疗结果均显示,与任何一个单药治疗相比,联合治疗能够更有效地抑制乳腺肿瘤的生长。这为乳腺癌,特别是CCL20高表达的乳腺癌患者的临床治疗提供了新思路。
复旦大学附属肿瘤医院博士后张蕊和博士研究生董梦雪为该论文的第一作者;柳素玲教授和复旦大学附属肿瘤医院张璐为该论文的通讯作者。
原文链接:https://www.nature.com/articles/s41392-023-01337-3