徐建青、张晓燕教授团队《Journal for ImmunoTherapy of Cancer》报道一种全新的、肿瘤微环境激活杀伤的CAR-T,有潜力成为不同实体瘤有效治疗手段
近年来,CAR-T疗法治疗血液源性肿瘤效果显著,然而在针对实体瘤的临床研究中却遭遇重大挑战。目前CAR-T均为靶点激活杀伤,而肿瘤靶点通常也在正常组织低表达,进而产生“on-target, off-tumor”现象、诱生炎症因子风暴、中枢神经毒性等,给CAR-T治疗带来严重的安全隐患。肿瘤细胞的异质性进一步导致靶点激活杀伤有效性受到挑战。即目前的靶点激活杀伤的CAR-T技术在在治疗实体瘤中,安全性与有效性上均遭遇重大挑战。
如何摆脱靶点依赖、将CAR-T技术进化为新一代肿瘤微环境激活杀伤,从而对不同的实体瘤均安全有效是领域内一直追逐的热点、也是该领域的技术高地。
复旦大学生物医学研究院徐建青和张晓燕教授团队设计了一种缺氧诱导转录放大(hypoxia-inducible transcription amplification, HiTA)系统以严格调控CAR分子在肿瘤缺氧微环境的条件性表达,从而首次真正实现严格区分肿瘤与正常组织,该部分工作以Conditioned CAR-T cells by hypoxia-inducible transcription amplification (HiTA) system significantly enhances systemic safety and retains antitumor efficacy为题于2021年10月6日在Journal for Immunotherapy of Cancer杂志发表。

数据显示:该团队设计的HiTA-CAR-T在体外仅在低氧条件下特异性分泌高水平IL-2、IFN-γ,且对肿瘤靶细胞呈现高效杀伤,而在常氧条件下几乎完全无杀伤活性;而传统的CAR-T在常氧与低氧条件下呈现相似的杀伤活性(图1)。
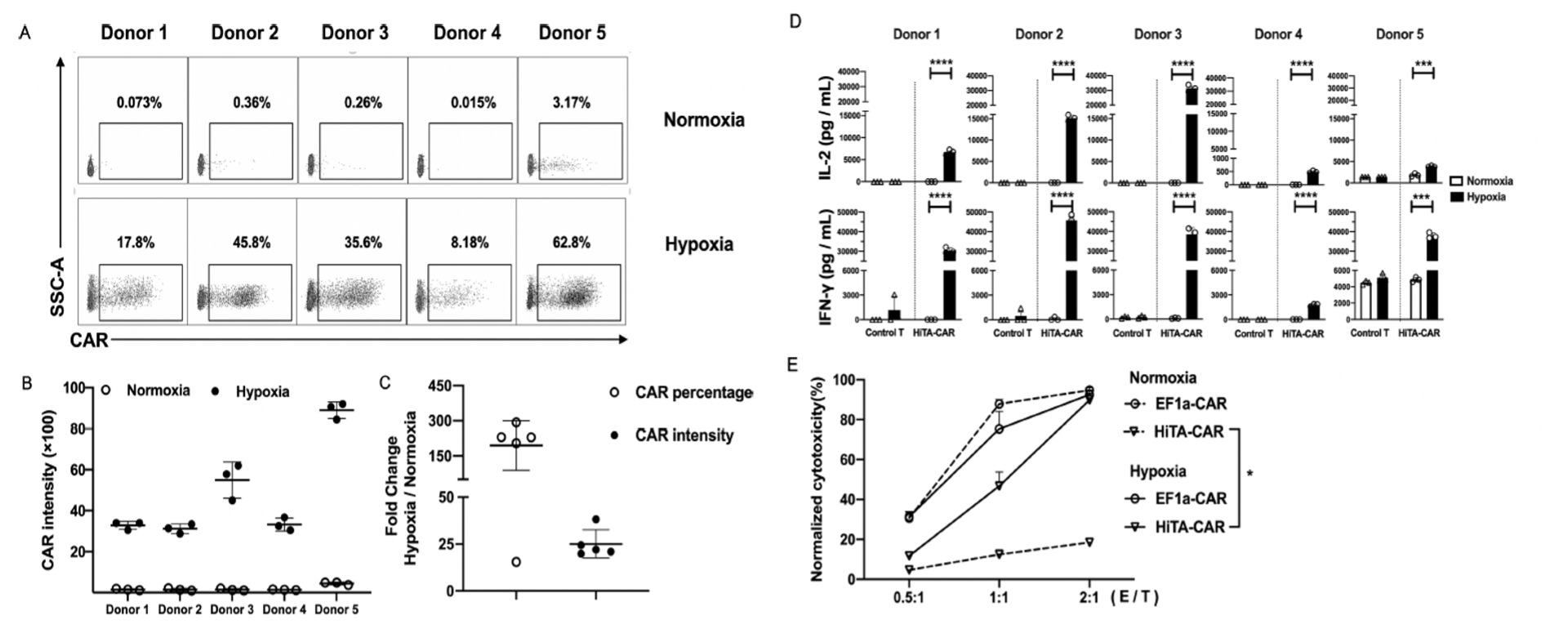
图1:HiTA-CAR-T细胞CAR的表达、活化和杀伤功能严格受缺氧调控
随后他们在肝脏人源化小鼠安全性评估模型和小鼠皮下移植瘤模型中分别评估了HiTA-CAR-T在体内的安全性和抗肿瘤有效性。小鼠血清AST、ALT以及IFN-γ、IL-2、TNF-α细胞因子检测结果显示,HiTA-CAR-T细胞在小鼠体内未造成on-target肝毒性和全身毒性。相反,传统CAR-T细胞对小鼠造成严重的肝损伤和系统毒性(图2)。更重要的是,HiTA-CAR-T细胞在小鼠移植瘤模型中显著抑制肿瘤的生长或清除肿瘤,其抗肿瘤效果显著(图3)。
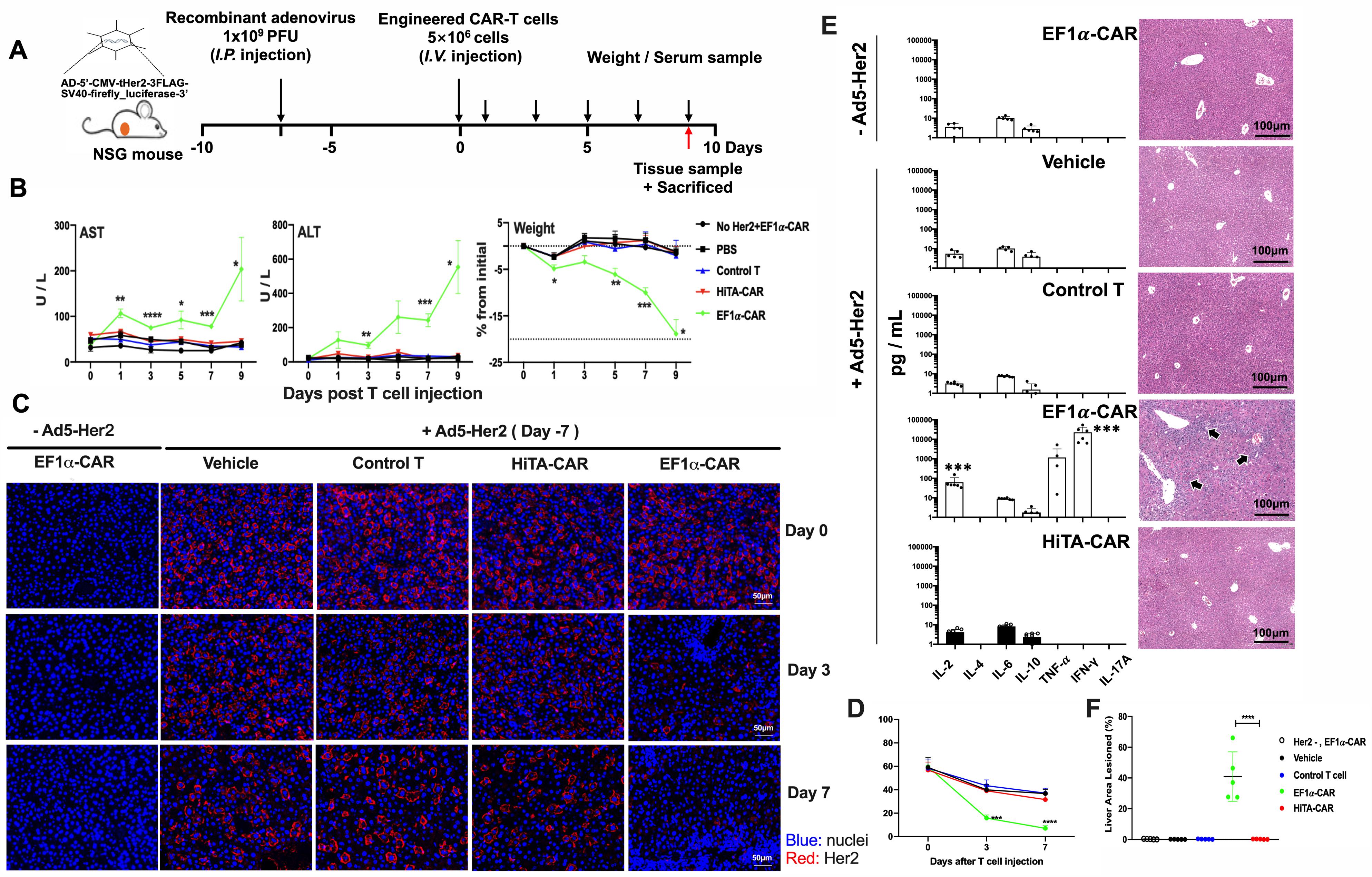
图3:HiTA-CAR-T细胞未造成on-target肝毒性和系统毒性
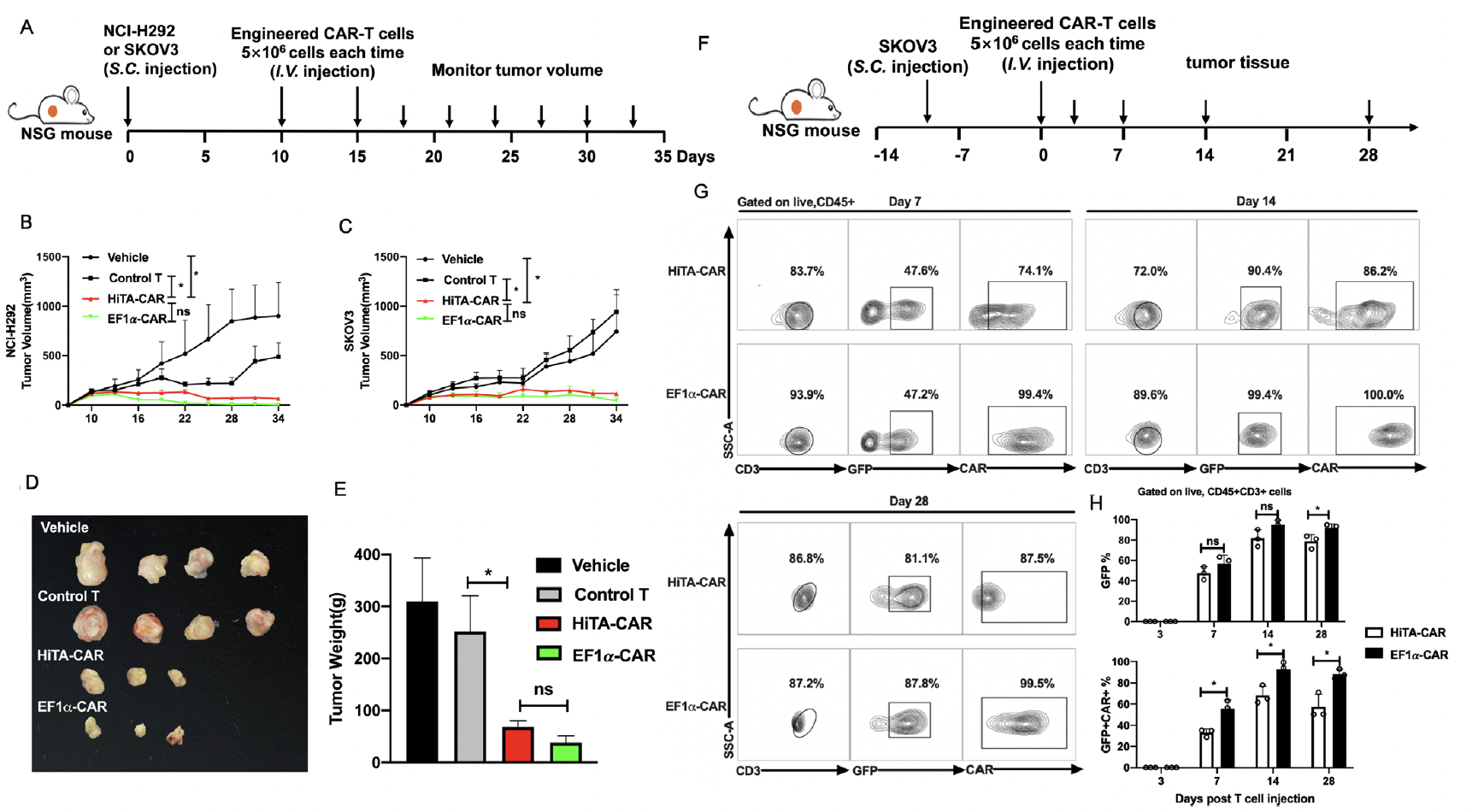
图4:HiTA-CAR-T细胞可显著抑制小鼠肿瘤生长
该部分工作的发表标志着不依赖靶点激活,而通过识别肿瘤微环境激活杀伤的新一代CAR-T技术成为可能;该技术单独或与溶瘤病毒联合,将有潜力成为不同实体瘤的有效治疗手段。
该文的通讯作者为复旦大学生物医学研究院徐建青研究员、张晓燕研究员,上海市公共卫生临床中心袁敏副主任。复旦大学IBS博士研究生何欢和廖启彬为并列第一作者。
原文链接:
https://jitc.bmj.com/content/9/10/e002755