徐彦辉团队《Cell Research》揭示人源RNA 聚合酶 III转录延伸复合物的结构和转录调控机制
在真核生物中,三种结构保守的RNA聚合酶(Pol I,Pol II和 Pol IIII)分别介导不同基因的转录,合成不同类型的RNA。Pol I 定位在细胞核核仁中,主要转录rRNA;Pol II、Pol III均位于细胞核核质中,其中Pol II负责转录合成mRNA, Pol III负责转录合成tRNA、5S rRNA、U6 RNA等其他非编码小RNA。Pol III是真核生物中组成最为复杂的聚合酶,包含17个亚基,可分为结构保守的催化核心模块和外周调控模块。临床试验证明,Pol III的突变和异常组装会导致特雷彻·柯林斯综合征、异染性脑白质营养不良、贝克威斯韦德曼氏症等疾病的发生。
2021年3月5日我院徐彦辉团队在Cell Research杂志在线发表研究论文“Structure of human RNA polymerase III elongation complex”。该研究利用低温冷冻电镜单颗粒重构方法,解析了原子分辨率的人源 Pol III转录延伸复合物的两种状态(backtracked and post-translocation)的三维结构,揭示了其转录调控的机理。

该研究表明,相比较于酵母的Pol III,人源Pol III具有结构保守的催化核心和独特的外周调控模块。RPC10是具有核酸内切酶活性并且发挥转录校准功能的亚基,其N端结构域稳定结合在RPC4-RPC5二聚体上,而C端结构域在不同的状态下会发生大的构象变化。在post-translocation状态下,RPC10的C-ribbon表现出高度的柔软性。而在backtracked状态下,RPC10的C-ribbon稳定结合在Pol III催化活性中心附近,为Pol III的高保真转录提供保障。这也与RPC10在Pol III转录终止中的作用相吻合。
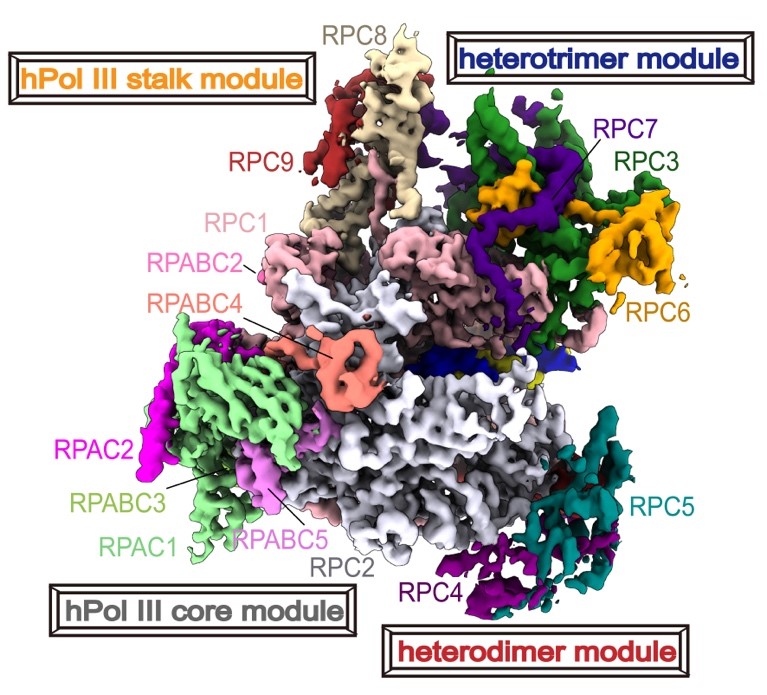
人源RNA聚合酶III的冷冻电镜结构
RPC7有两种亚型,分别为RPC7a和RPC7b组成两种不同的聚合酶复合物。其中,RPC7a主要在未分化细胞和癌症细胞中有特异性表达。结构分析发现RPC7a的N端结构域和RPC6的WH1结构域共同作用在PRC1的clamp上,这个相互作用面与MAF1(Pol III的负调控因子)与clamp结合面正好重叠,而RPC7b则不具备结合在相同位置的能力。这个研究结果从结构角度阐明了RPC7a可以避开MAF1对Pol III转录抑制作用的机制。

在此研究论文审稿过程中,国际上有三个研究小组(上图)发表了关于人源Pol III的研究工作,基本结构模型相似,但着重点各有不同,从多个角度共同揭示了人源Pol III的结构特征以及可能的转录调控机制。
徐彦辉课题组博士后李良,博士生于子朔,赵丹为本文共同第一作者,徐彦辉研究员和侯海峰副研究员为共同通讯作者。中科院生物物理所成像中心、国家蛋白质中心、上科大冷冻电镜中心,以及正在建设中的复旦大学上海医学院电镜中心,对该研究的数据收集给予了重要的支持。
论文原文链接:https://www.nature.com/articles/s41422-021-00472-2